
����Ŀ������ͼ���ֻ�����Ľṹ������������ȷ����( )
��A��B�ķ���ʽ��ΪC10H14O2���ǻ�Ϊͬ���칹�壻 ���������ʽΪC9H12O2���л���һ��Ϊͬϵ��
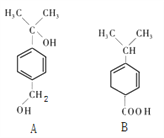
��A��B�����й�ƽ���̼ԭ������ͬ
��A��B����ʹ���Ը��������Һ��ɫ
�����ú�������������������ú˴Ź�����������A��B
��A��B���������ֹ�����
��1molA���������������Ʒ�Ӧ��1molB�������ı���̼��������Һ��Ӧ������������ʵ���Ϊ2:1
��1molB��1molBr2�����ӳɷ�Ӧ���������ֲ�ͬ����������ֲ��ﻥΪͬ���칹��
A. �٢ڢۢܢݢޢ� B. ֻ�Тۢޢ� C. ֻ�Т� D. ֻ�Тۢ�
���𰸡�D
����������A��B�ķ���ʽ��ΪC10H14O2�����ǻ�Ϊͬ���칹�壻���������ʽΪC9H12O2���л��ﲻһ��Ϊͬϵ��ٴ���A�к��б�����B�����в����ڱ������Һ��еı���̼ԭ�Ӹ�����ͬ����ƽ���̼ԭ������������ͬ���ڴ���A�к����ǻ���B�к���̼̼˫��������ʹ���Ը��������Һ��ɫ������ȷ����A��B��������ԭ�����ͬ��Ҳ���ú˴Ź�����������A��B���ܴ���A�к����ǻ�һ�ֹ����ţ�B�к���̼̼˫�����Ȼ����ֹ����ţ��ݴ���1molA���������������Ʒ�Ӧ����1mol������1molB�������ı���̼��������Һ��Ӧ����1molCO2��������������ʵ���Ϊ1:1������B�����к���2��̼̼˫����1molB��1molBr2�����ӳɷ�Ӧ���������ֲ�ͬ�������1��2���ӳ����֣�1��4���ӳ�һ�֣��������ֲ��ﻥΪͬ���칹�壬����ȷ����ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������0.1molCH3COONa��0.05molHCl����ˮ���1L��Һ(pH��7).
��1�������ӷ���ʽ��ʾ����Һ�д��ڵ�����ƽ����ϵ______________��_______________��___________________
��2����Һ�и����ӵ����ʵ���Ũ���ɴ�С˳��Ϊ_____________________________________________________
��3����Һ��������Ũ��Ϊ0.1mol/L����________________��Ũ��Ϊ0.05mol/L����____________________
��4�����ʵ���֮��Ϊ0.lmol������������______________��__________
��5��CH3COO-��OH-�����ʵ���֮�ͱ�H+��________mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A. 0.5mol�ۻ�(As4S4)���ṹ����ͼ������NA��S-S��![]()
B. ��1molNH4NO3��������ϡ��ˮ�У�������Һ�����ԣ�����Һ��NH4+����ĿΪNA
C. ��״���£�33.6L���ȼ����к�����ԭ�ӵ���ĿΪ3NA
D. �����£�16.8gFe������ˮ������ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��B����ȴװ��δ���������������Ϳ����������뷴Ӧ���������Լ1:3���ͨ�뺬ˮ8%��̼�������Ʊ�Cl2O������ˮ����Cl2O�Ʊ���������Һ��

��֪��Cl2O��������ˮ����ˮ��Ӧ����HClO��Cl2O�ķе�Ϊ3.8�棬42�����Ϸֽ�ΪCl2��O2��
(1)��ʵ���п����������������ȵķ�����_____________________��
��Ϊʹ��Ӧ��ֽ��У�ʵ���в�ȡ�Ĵ�ʩ��___________________________��
(2)��д��װ��B�в���Cl2O�Ļ�ѧ����ʽ��_________________________��
����B����ȴװ�ã������C�е�Cl2O��������١���ԭ����_____________________��
(3)װ��C�в�����ɫԲ����ƿ����Ϊ______________________��
(4)��֪������ɱ�H2O2��FeCl2�����ʻ�ԭ��Cl�����ⶨC�д�������Һ�����ʵ���Ũ�ȵ�ʵ�鷽��Ϊ������ʽ�ζ���ȷ��ȡ20.00 mL��������Һ��________������ѡ�õ��Լ���H2O2��Һ��FeCl2��Һ��AgNO3��Һ����������������ʹ�õ������У�������ƽ����ո����䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C+CO22CO��Q1 �� ��Ӧ����v1��N2+3H22NH3+Q2��Ӧ����v2 �� ����������Ӧ�����¶�����ʱ��v1��v2�ı仯���Ϊ�� ��
A.ͬʱ����
B.ͬʱ��С
C.v1����v2��С
D.v1����v2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������履��ʯ��ˮ��ͨ�������̼�������Һ������(I��ʾ��������)�ı仯������������������Ĺ�ϵ��ȷ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��ͬѧ��ʵ�����ü���1-������ŨH2SO4���廯�ƻ����ķ������Ʊ�1-�嶡�飬�����鷴Ӧ�IJ��ָ�����������ͼ��ʾװ�ã����мг�������������������ȴˮ��û�л�����
��֪��NaBr+H2SO4=NaHSO4+HBr
��CH3(CH2)2CH2OH+HBr![]() CH3(CH2)2CH2Br+H2O
CH3(CH2)2CH2Br+H2O
����Ӧ�������
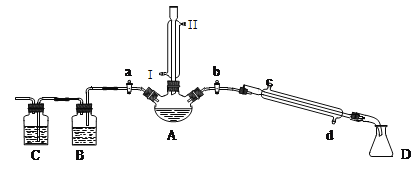
�����ʵ�鲽�裬�ش��������⣺
��1���ر�a��b����ͨ��ֱ�����ܵ�����ˮ����A����30���ӣ��Ʊ�1-�嶡�顣��ֱ�����ܽ�ͨ����ˮ����ˮ����_____(�I����)��������������ҪĿ����________��
��2�������ϣ�������Ӧ�ĸ���������У�����(CH3CH2CH2CH2-O-CH2CH2CH2CH3)��1-��ϩ���廯�⡢�������ơ�ˮ�ȡ�Ϩ��ƾ��ƣ�����ֱ�������Ϸ��������Ӳ���a���������ȼ�����Ӧֱ����ȴ��ͨ��B��Cװ�ü��鲿�ָ�����B��C��Ӧʢ�ŵ��Լ��ֱ���ʯ�����ˮ��Bװ�ó���ʯ�ﻹ����______(���Լ�����)д��Cװ������Ҫ�Ļ�ѧ����ʽ��_________________________________________________��
��ͬѧ��ͨ����������Ǽ������ò������Ƿ�������CH2CH2CH2CH3���� ��ȷ���������д��ڶ��ѡ�����Ը�ͬѧ�Ĺ۵��������________________________________��
��3��Ϊ�˽�һ�������ᴿ1-�嶡�飬����ȤС��ͬѧ�������л�������������ʾ��
���� | �۵�/�� | �е�/�� |
1-���� | -89.5 | 117.3 |
1-�嶡�� | -112.4 | 101.6 |
���� | -95.3 | 142.4 |
1-��ϩ | -185.3 | -6.5 |
���㲹������ʵ�鲽�裬ֱ�������1-�嶡�顣
�ٴ���ƿ��ȴ��ȥ��ֱ�������ܣ�
�ڲ��ϴ���Ƥ�����¶ȼƣ�
�۹ر�_______����_______��
�ܽ�ͨ�����ܵ�����ˮ��ʹ��ˮ��______�����룻
��Ѹ�������¶���_______�棬�ռ�������֡�
��4����ʵ������ȡ1-������NaBr�ֱ�Ϊ7.4 g��13.0 g�������Ĵֲ��ᆳϴ�ӡ�������ٴ�����õ�10.96 g 1-�嶡�飬��1-�嶡��IJ�����_____��������2λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A. 2g D218O������������ΪNA
B. 2.24L Cl2ͨ������H2O��NaOH��Һ��ת�Ƶĵ�������Ϊ0.1NA
C. 1mol/L̼��������Һ�е�HCO3����ĿС��NA
D. һ�������£�39g����Ȳ�ͱ�����������������ԭ������Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ش�����˵����ȷ����
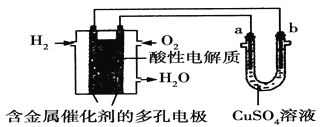
A. ��װ���������������ͭʱ��aΪ����
B. ��װ�������ڵ��ͭʱ������ͭ��Һ��Ũ����С��
C. ȼ�ϵ����������ӦΪ��O2��4e����2H2O===4OH-
D. ���ø�װ�ý��д�ͭ�ľ���������1 molˮ����ʱ��b�缫������63.5 g��a�缫�·��в����ؽ����ࡣ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com