
| 3.42g |
| 171g/mol |
| 1.165g |
| 233g/mol |
| 3.42g |
| 171g/mol |
| 1.165g |
| 233g/mol |


科目:高中化学 来源: 题型:
| A、经测定某物质只含一种元素,则该物质一定是单质 |
| B、难溶于水的电解质一定是弱电解质 |
| C、离子化合物中可能含有共价键 |
| D、既能与酸又能与碱反应的化合物一定是两性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
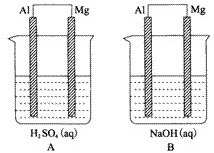
查看答案和解析>>
科目:高中化学 来源: 题型:
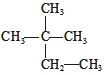 ③白磷 ④氯水 ⑤
③白磷 ④氯水 ⑤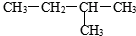 ⑥
⑥35 17 |
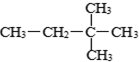 ⑧2,2-二甲基丁烷⑨红磷 ⑩
⑧2,2-二甲基丁烷⑨红磷 ⑩37 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:查看答案和解析>>
科目:高中化学 来源: 题型:
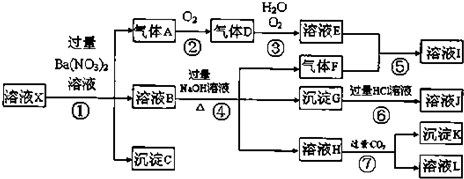
查看答案和解析>>
科目:高中化学 来源: 题型:
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠水解:S2-+2H2O?H2S+2OH- |
| B、碳酸钠与醋酸溶液反应:CO32-+2H+=H2O+CO2↑ |
| C、HCO3-的电离:H2O+HCO3-?CO32-+H3O+ |
| D、NaHS在水中的电离:NaHS?Na++HS- HS-?H++S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com