
| A、硫化钠水解:S2-+2H2O?H2S+2OH- |
| B、碳酸钠与醋酸溶液反应:CO32-+2H+=H2O+CO2↑ |
| C、HCO3-的电离:H2O+HCO3-?CO32-+H3O+ |
| D、NaHS在水中的电离:NaHS?Na++HS- HS-?H++S2- |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 正极 | 负极 | 电解质溶液 | |
| A. | Ag | Cu | AgNO3 |
| B. | Zn | Cu | FeCl3 |
| C. | C | Cu | FeCl3 |
| D. | Cu | Ag | Fe2(SO4)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | I | Ⅱ | Ⅲ |
| 实验 | 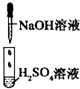 |
 |
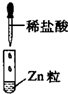 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A、I中混合前后溶液中各离子种类、个数均不变 |
| B、Ⅱ中反应前后溶液中Cu2+、Cl-浓度均未变 |
| C、Ⅱ中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同 |
| D、Ⅲ中发生的反应属于置换反应,不属于离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大压强,活化分子数增多 |
| B、升高温度,活化分子百分数增大 |
| C、使用催化剂能降低反应热 |
| D、加入反应物,使活化分子百分数增加,化学反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com