
【题目】有周期表序数前20 的A、B、C、D、E五种元素,原子序数E<C<D<A<B;E原子是最外电子层有4个电子;A-离子和B+离子的核外电子层结构相同;D的气态氢化物的化学式为H2D,D在其最高价氧化物中的质量分数为40%,且D原子核内质子数和中子数相等;C的原子序数比D少5,比B少8。
(1)各元素的名称为A_____、B_____、C_____、D_____、E_____。
(2)D元素位于第____周期____族。
(3)五种元素最高价氧化物的水化物中,酸性最强的是___(写化学式下同),碱性最强的是____。
(4)写出C元素的单质与水反应的离子方程式______。
(5)写出B元素的氧化物的电子式________。
(6)写出E元素的氢化物的结构式________。
【答案】氯 钾 钠 硫 碳 三 ⅥA HClO4 KOH 2Na+2H2O=2Na++2OH-+H2↑ K+[![]() ]2-K+
]2-K+ 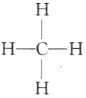
【解析】
由D的气态氢化物的化学式为H2D,D在其最高价氧化物中的质量分数为40%,且D原子核内质子数和中子数相等可知,D为S元素;由原子序数E<C<D<A<B,A-离子和B+离子的核外电子层结构相同可知,A为Cl元素,B为K元素;由C的原子序数比D少5,比B少8可知,C为Na元素;由E原子是最外电子层有4个电子可知,E为C元素。
(1)A为Cl元素,B为K元素,C为Na元素,D为S元素,E为C元素,名称分别为氯、钾、钠、硫、碳,故答案为:氯;钾;钠;硫;碳;
(2)D元素为S元素,位于第三周期ⅥA族,故答案为:三;ⅥA;
(3)元素非金属性越强,最高价氧化物对应水化物的酸性越强,五种元素中Cl元素非金属性最强,K元素金属性最强,则酸性最强的是HClO4,碱性最强的是KOH,故答案为:HClO4;KOH;
(4)C为Na元素,金属钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(5)B为K元素,氧化钾为离子化合物,电子式为K+[![]() ]2-K+,故答案为:K+[
]2-K+,故答案为:K+[![]() ]2-K+;
]2-K+;
(6)E为C元素,C元素最简单的氢化物为甲烷,甲烷的分子式为CH4,结构式为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图表示构成细胞的元素、化合物及其作用,a、b、c、d代表不同的小分子物质,A,B,C代表不同的大分子物质,下列叙述错误的是( )

A. 在动物细胞内,与物质A作用最相近的物质是糖原
B. 若B代表的物质能降低血糖浓度,则与其合成、分泌密切相关的细胞器有核糖体和高尔基体等
C. b→B的生理过程完成的场所在核糖体,且有水的产生
D. a、b、c、d分别为葡萄糖、氨基酸、脱氧核苷酸和促性腺激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中的反应物和生成物有FeCl3、FeCl2、Cu、CuCl2。有人将上述反应设计成原电池。
(1)则该电池负极材料为:__________________,负极反应式为________________;
(2)正极材料为:_____________,该电池总的化学反应式为_______________;
(3)一段时间后负极质量减轻m g,则下列说法正确的是:________(填写序号)。
A.电路中通过的电子为m/32 mol
B.正极质量增加56m/64 g
C.原电池工作过程中电子由正极经导线流向负极
D.原电池工作过程中Cl向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法中正确的是( )
A.有一种元素被氧化,必有另一种元素被还原
B.氧化反应的本质是得电子
C.原子得到电子后,元素的化合价一定升高
D.有单质参加或生成的反应不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.氢氧化铜不稳定,受热分解生成氧化铜和水
B.氢氧化铜是一种弱碱,能与酸反应生成盐和水
C.硫酸铜溶液中加入烧碱溶液有氢氧化铜蓝色沉淀生成
D.氧化铜是一种碱性氧化物,能与水反应生成氢氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①②③三瓶体积相等,浓度都是1 mol/L的HCl溶液,将①加热蒸发体积至体积减少一半,在②中加入少量CH3COONa固体,加入后溶液仍呈强酸性,③不作改变。然后以酚酞做指示剂,用NaOH溶液滴定上述三种溶液,可观察到所消耗的NaOH溶液体积是( )
A.①=③>②B.③>②>①C.③=②>①D.①=②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20mi时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。试回答:
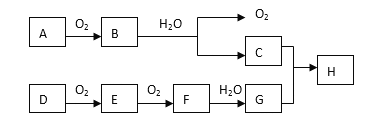
(1) G的化学式为________;
(2)写出B的电子式______________。
(3)写出B +水→C的化学反应方程式_______。
(4)B和E反应也可生成H,则该反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com