
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①配制500mL0.1molL-1H2SO4,所需的定量仪器有______,②再用0.1molL-1H2SO4洗涤Fe粉,其目的是______,然后用蒸馏水洗涤至中性;③将KNO3溶液的pH调至2.5;④为防止空气中的O2对脱氮的影响,对KNO3溶液的处理方法为______。
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式______。

(3)研究表明铁粉和活性炭粉混合使用可提高脱氮的效率,其可能的原因是______。
(4)根据图说明,地下水中的CO32-会使脱氮效率偏低可能的原因______。
(5)处理后的废液经过一定的加工步骤,可以转化为硝酸铁,用作媒染剂、铜着色剂、医药等,若0.56吨经稀H2SO4、蒸馏水洗涤并干燥后的铁粉,处理废液后,最后可以转化为硝酸铁固体______吨。
【答案】量筒(或酸式滴定管)、500mL容量瓶 除去铁锈 通入过量的氮气(或加热煮沸) 4Fe+NO3-+10H+=4Fe2++NH4++3H2O 铁和碳粉形成原电池,加速硝酸根离子的还原 碳酸根离子水解呈碱性,溶液碱性越强,脱氮效率越低 2.42
【解析】
(1)选量筒或酸式滴定管量取酸性溶液,在500m容量瓶中定容,铁的氧化物与稀硫酸反应,利用氮气或加热排出氧气;
(2)t1时刻前,发生氧化还原反应生成亚铁离子、铵根离子;
(3)铁粉和活性炭粉混合使用可提高脱氮的效率,与构成原电池有关;
(4)地下水中的CO32-会使脱氮效率偏低,与水解显碱性有关;
(5)结合Fe~Fe(NO3)3计算。
(1)实验前:①配制500mL 0.1molL-1H2SO4,所需的定量仪器有量筒(或酸式滴定管)、500mL容量瓶;
②再用0.1molL-1H2SO4洗涤Fe粉,其目的是除去铁锈,然后用蒸馏水洗涤至中性;③将KNO3溶液的pH调至2.5;④为防止空气中的O2对脱氮的影响,对KNO3溶液的处理方法为通入过量的氮气(或加热煮沸);
(2)t1时刻前该反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
(3)研究表明铁粉和活性炭粉混合使用可提高脱氮的效率,其可能的原因是铁和碳粉形成原电池,加速硝酸根离子的还原;
(4)地下水中的CO32-会使脱氮效率偏低可能的原因为碳酸根离子水解呈碱性,溶液碱性越强,脱氮效率越低;
(5)由Fe~Fe(NO3)3可知,最后可以转化为硝酸铁固体为![]() ×242t=2.42t。
×242t=2.42t。


科目:高中化学 来源: 题型:
【题目】铁元素与我们的生活息息相关。回答下列问题:
(1)硝普钠(Na2[Fe(CN)5(NO)] 2H2O)可用于治疗急性心率衰竭。
①Fe3+的价电子轨道表示式为____________。
②硝普钠中不存在的作用力有____________(填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键 e.非极性共价键 f.氢键
③硝普钠的内界[Fe(CN)5(NO)]2-中,非金属元素的第一电离能由大到小的顺序为______,由其中两种元素按原子个数比为1:3组成的常见阴离子的空间构型为_________。
(2)三氯化铁是一种重要的铁盐,熔沸点较低,易溶于丙酮。
①FeCl3晶体类型为____________。
②FeCl3的熔点(555K)高于AlCl3(467K)的原因是_______________。
③Fe3+可用KSCN溶液检验,SCN-中σ键和π键的个数比为_______。
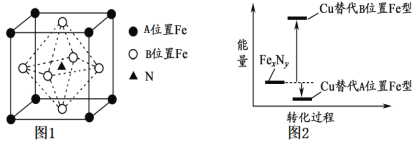
(3)某FexNy的晶胞如下图1所示,其化学式为____________,Cu可完全替代该晶体中的A位置Fe或B位置Fe,形成产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如下图2所示。其中更稳定的Cu替代型产物晶体的密度为ρ gcm-3,阿伏加德罗常数为NA,求晶胞参数a=___nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化汞(HgCl2)可用于木材和解剖标本的保存、皮革鞣制和钢铁镂蚀,是分析化学的重要试剂,可做消毒剂和防腐剂。
(1)①HgCl2在水中稍有水解:HgCl2+H2O![]() Hg(OH)Cl+HCl,为了抑制上述反应①中HgCl2的水解,可以采取的措施是_________。(选填编号)
Hg(OH)Cl+HCl,为了抑制上述反应①中HgCl2的水解,可以采取的措施是_________。(选填编号)
a. 加水稀释 b. 增加HCl的浓度 c. 及时移走产物 d. 降温
②HgCl2与稀氨水反应则生成难溶解的氨基氯化汞,化学方程式为:HgCl2+2NH3→Hg(NH3)Cl↓+NH4Cl,上述反应的短周期元素中,非金属性最强元素原子的最外层电子排布式为_______,该原子核外电子云有______种不同的伸展方向。
(2)已知PCl3与NH3分子结构相似,PCl3的电子式是________;PCl3与NH3的沸点比较,_____高,其原因是_____________。
(3)氮的一种氢化物HN3可用于有机合成,其酸性与醋酸相似,若HN3与氨水混合,此反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成1 mol O2的同时生成2 mol NO2
②单位时间内生成1 mol O2的同时生成2 mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①②③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
A. 放电时电解质溶液中的OH-向正极移动
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性增强
D. 充电时阳极反应:Ni(OH)2-e- + OH- = NiOOH + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8molH2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101kPa下测得的热量)。该反应的热化学方程式为__。又已知:H2O(l)=H2O(g)ΔH=+44kJ/mol。则16g液态肼与过氧化氢反应生成液态水时放出的热量是__kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )

A.a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
B.放电时,电子从a极经过负载流向b极
C.该电池持续放电时,离子交换膜需选用阴离子交换膜
D.电路中转移电子3NA时消耗氧气16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6mol·L-1的H2SO4溶液中,乙同学将两电极放入6mol·L-1的NaOH溶液中,装置如图所示。

(1)写出图1中正极的电极反应式: _______________ 。
(2)图2中负极为 _______________ ,总反应的离子方程式为 ____________ 。
(3)甲、乙同学都认为“如果构成原电池的电极材料都是金属,则作负极的金屈应比作正极的金属活泼”,则甲同学得出的结论是 _______________ 的活动性更强,乙同学得出的结论是 _______________ 的活动性更强。
(4)由该实验得出的下列结论中,正确的有 _______________ (填序号)。
a.利用原电池反应判断金属活动性强弱时应注意原电池中的电解质溶液
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序表已过时,没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com