
【题目】铁元素与我们的生活息息相关。回答下列问题:
(1)硝普钠(Na2[Fe(CN)5(NO)] 2H2O)可用于治疗急性心率衰竭。
①Fe3+的价电子轨道表示式为____________。
②硝普钠中不存在的作用力有____________(填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键 e.非极性共价键 f.氢键
③硝普钠的内界[Fe(CN)5(NO)]2-中,非金属元素的第一电离能由大到小的顺序为______,由其中两种元素按原子个数比为1:3组成的常见阴离子的空间构型为_________。
(2)三氯化铁是一种重要的铁盐,熔沸点较低,易溶于丙酮。
①FeCl3晶体类型为____________。
②FeCl3的熔点(555K)高于AlCl3(467K)的原因是_______________。
③Fe3+可用KSCN溶液检验,SCN-中σ键和π键的个数比为_______。
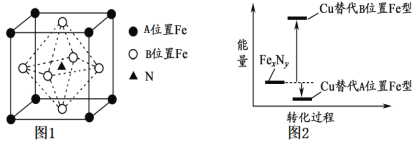
(3)某FexNy的晶胞如下图1所示,其化学式为____________,Cu可完全替代该晶体中的A位置Fe或B位置Fe,形成产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如下图2所示。其中更稳定的Cu替代型产物晶体的密度为ρ gcm-3,阿伏加德罗常数为NA,求晶胞参数a=___nm。
【答案】![]() b、e N>O>C 平面三角形 分子晶体 二者均为分子晶体,且组成和结构相似,FeCl3的相对分子质量大,分子间作用力(或范德华力)大 1:1 Fe4N
b、e N>O>C 平面三角形 分子晶体 二者均为分子晶体,且组成和结构相似,FeCl3的相对分子质量大,分子间作用力(或范德华力)大 1:1 Fe4N 
【解析】
(1)①Fe的原子序数为26,依据基态原子的价层电子排布式书写Fe3+的价电子轨道表示式;
②根据络合物中存在的作用力判断;
③依据第一电离能的规律作答;根据价层电子对互斥理论分析空间构型;
(2)①根据给定的物理性质分析晶体类型;
②分子晶体的相对分子质量越大,分子间作用力(或范德华力)大;
③1个共价单键中含1个σ键,一个共价双键中含1个σ键和1个π键,再结合SCN-内化学键类型分析;
(3)利用“均摊法”计算出晶胞内Fe和N的个数,进而求出化学式;
由图2可知,Cu替代A位置的Fe时能量较低,更稳定,则Cu位于顶点,均摊法确定化学式,晶胞质量除以晶胞的体积得密度;
(1)①Fe原子的核外电子数为26,基态原子的价层电子排布式为3d64s2,失去3个电子得到Fe3+,则其价电子轨道表示式为![]() ;
;
②硝普钠(Na2[Fe(CN)5(NO)] 2H2O)中存在离子键、配位键、极性共价键和氢键,不存在金属键和非极性共价键,故答案选b、e;
③硝普钠的内界[Fe(CN)5(NO)]2-中,非金属元素为C、N和O,同周期元素的第一电离能呈增大趋势,但N元素的最高能级2p能级上为半充满结构,处于稳定状态,其第一电离能比O的大,因此第一电离能由大到小的顺序为N>O>C;C、N、O中两种元素按原子个数比为1:3组成的常见阴离子有CO32-、NO3-,CO32-、NO3-中中心原子的价层电子对数都为3,且中心原子上没有孤电子对,所以CO32-、NO3-的空间构型都为平面三角形;
(2)①三氯化铁是一种重要的铁盐,熔沸点较低,易溶于丙酮,属于分子晶体的物理特点,因此其晶体类型为分子晶体;
②FeCl3和AlCl3均为分子晶体,之所以FeCl3的熔点高,是因为二者组成和结构相似,FeCl3的相对分子质量大,分子间作用力(或范德华力)大;
③SCN-与CO2互为等电子体,CO2的结构式为O=C=O,1个CO2分子中含2个σ键和2个π键,因此SCN-中σ键和π键的个数比为1:1;
(3)根据图1可知,Fe在晶胞中的个数为:8×1/8+6×1/2=4,N位于体心,则只有1个N,则化学式为:Fe4N;由图2可知,Cu替代A位置的Fe时能量较低,更稳定,则Cu位于顶点,原子个数为8×1/8=1,Fe位于面心,原子个数为6×1/2=3,N位于体心,则只有1个N,其化学式为Fe3CuN,则晶胞的质量为![]() =
=![]() g,设晶胞的参数为anm,根据晶体密度ρg/cm3=
g,设晶胞的参数为anm,根据晶体密度ρg/cm3=![]() =
= 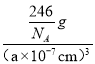 ,解得a=
,解得a= ,故答案为:Fe4N;
,故答案为:Fe4N; 。
。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )

A. 盐酸中逐滴加入氢氧化钠溶液
B. 硫酸铜溶液中逐滴加入氢氧化钡溶液
C. 硫酸中逐滴加入氯化钡溶液
D. 盐酸中逐滴加入硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生可逆反应2NO(g)+O2(g)![]() 2NO2(g),不能说明该反应已经达到平衡状态的是
2NO2(g),不能说明该反应已经达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
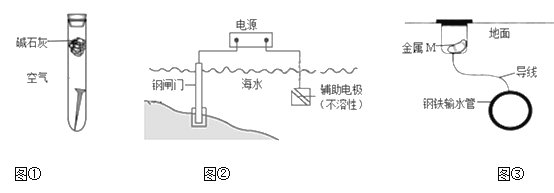
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C. 图②,若断开电源,钢闸门将发生吸氧腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。

(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起_______的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂 除去。
(5)写出烧瓶a中发生反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) △H﹥0,则金刚石比石墨稳定
C. 已知H+(aq)+OH–(aq)=H2O(1) △H = -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3kJ
D. 一定条件下2SO2(g)+O2(g) ![]() 2SO3(g) △H1 ,2SO2(g)+O2(g)
2SO3(g) △H1 ,2SO2(g)+O2(g) ![]() 2SO3(l) △H2 则△H1>△H2
2SO3(l) △H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①配制500mL0.1molL-1H2SO4,所需的定量仪器有______,②再用0.1molL-1H2SO4洗涤Fe粉,其目的是______,然后用蒸馏水洗涤至中性;③将KNO3溶液的pH调至2.5;④为防止空气中的O2对脱氮的影响,对KNO3溶液的处理方法为______。
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式______。

(3)研究表明铁粉和活性炭粉混合使用可提高脱氮的效率,其可能的原因是______。
(4)根据图说明,地下水中的CO32-会使脱氮效率偏低可能的原因______。
(5)处理后的废液经过一定的加工步骤,可以转化为硝酸铁,用作媒染剂、铜着色剂、医药等,若0.56吨经稀H2SO4、蒸馏水洗涤并干燥后的铁粉,处理废液后,最后可以转化为硝酸铁固体______吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com