
(14分)水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂。实验室制备水杨酸甲酯装置示意图和有关数据如下:

反应原理:
实验步骤:
①在干燥的三颈烧瓶中入7.0g水杨酸、30mL(0.64moL)甲醇、3mL浓H2SO4和2~3片碎瓷片,在85~95 ℃下加热回流(如图甲);
②1.5h后将回流装置改为蒸馏装置,水浴加热(如图乙);
③余下的反应液冷却至室温,依次用水、碳酸钠溶液和水洗涤,后再分离(如图丙);
④分出的产物加入少量无水CaCl2固体,静置片刻后过滤,
⑤对滤液蒸馏纯化,收集221~224℃馏分,得水杨酸甲酯6.1g。
⑥其它量不变,改用2mL浓H2SO4 重复上述操作,得水杨酸甲酯5.5g.
回答下列问题:
(1)甲中所用三颈烧瓶应选用 ,
A、100mL B、150mL C、250mL D、500mL
(2)整个实验两次用到蒸馏装置,第一次用蒸馏装置的目的是: 。
(3)步骤③中所用到的玻璃仪器的名称是 ;
(4)本实验甲醇要过量,其目的是 ,
(5)步骤③要进行两次水洗,如果没有进行第二次水洗,可能的后果是 。
(6)浓H2SO4的用量为3mL时,水杨酸甲酯的产率是 ,
(7)该实验中,浓硫酸主要表现了 性质。
(14分).
(1)A(2分);
(2)甲醇有毒,用于回收甲醇(2分)
(3)分液漏斗、锥形瓶(2分)。
(4)提高水杨酸的转化率(或水杨酸甲酯的产率)(2分)
(5)残留的碳酸钠与CaCl2反应生成沉淀堵塞分液漏斗,并在蒸馏时会促进水杨酸甲酯的水解(2分,答出一条即可)
(6)79.1%(2分)
(7)催化性、吸水性(2分)
【解析】
试题分析:(1)烧瓶内溶液的体积不能超过烧瓶容积的1/3,该实验中溶液的总体积大约是33mL左右,所以烧瓶的容积选择100mL即可,答案选A;
(2)第一次用蒸馏装置的目的回收甲醇,因为甲醇有毒,不能挥发到大气中;
(3)图丙为分液装置,仪器名称为分液漏斗和锥形瓶;
(4)甲醇过量的目的增大水杨酸的转化率;
(5)第一次水洗的目的是出去过量的甲醇,用碳酸钠洗涤的目的是除去水杨酸,第二次水洗的目的是除去过量的碳酸钠溶液,若没有进行第二次水洗,则下部操作中碳酸钠与氯化钙反应生成碳酸钙沉淀,堵塞分液漏斗,并在蒸馏时会促进水杨酸甲酯的水解;
(6)根据题意甲醇过量,所以计算水杨酸甲酯的理论产量按水杨酸的量进行计算,则理论上生成水杨酸甲酯的质量是7.0g/138g/mol×152g/mol=7.71g,而浓H2SO4的用量为3mL时,水杨酸甲酯的实际产量是6.1g,所以水杨酸甲酯的产率是6.1g/7.71g×100%=79.1%;
(7)首先浓硫酸是酯化反应的催化剂;当浓硫酸的用量 2mL时,水杨酸甲酯的产量减少,说明浓硫酸的存在有利于反应正向进行,则浓硫酸起到了吸水性和催化作用。
考点:考查对物质制备的实验分析、计算


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:填空题
(7分)(1)质子核磁共振谱是研究有机化合物结构的有力手段之一。结构中的等效氢原子在核磁共振谱中都给出了相应的峰值(信号),谱中峰的强度与结构中的H原子数成正比。试回答:
有机化合物 ,在核磁共振氢谱中观察到峰值给出的强度之比为_______________。
,在核磁共振氢谱中观察到峰值给出的强度之比为_______________。
(2)烷基取代苯 可以被KMnO4酸性溶液氧化生成
可以被KMnO4酸性溶液氧化生成 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化生成
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化生成 ,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成
,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成 的异构体共有7种,其中的2种是
的异构体共有7种,其中的2种是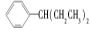 、
、
请写出其他5种的结构简式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列表达方式错误的是
A.甲烷的电子式:
B.氟化钠的电子式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子: C
C
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:推断题
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:

已知:HCO3-+ AlO2-+H2O== Al (OH)3↓+ CO32-
下列说法正确的是
A.气体乙和气体丙都为纯净物
B.固体粉末X中一定含有FeO、Na2S2O3、NaAlO2,可能含有Na2CO3、NaHCO3
C.溶液丁中的阳离子一定只含H+、Fe2+
D.溶液甲中一定含有AlO2-,可能含有CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
Ⅰ.(5分)15克有机物A完全燃烧只生成22克CO2和9克H2O。试求:
(1)该有机物的最简式 。
(2)符合该最简式的A物质有多种,则它们之间的关系 (填序号)
A、一定互为同系物
B、一定互为同分异构体
C、等质量的它们完全燃烧耗氧量相同
D、等物质的量的它们完全燃烧耗氧量相同
(3)若A的相对质量为90,且两分子A能反应形成六元环状酯,则A的结构简式为 。
Ⅱ.PTT优异性能,能作为纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:

其中A、B、C均为链状化合物,A能发生银镜反应,C不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,
C的名称(系统命名) 。
(2)由物质C与D反应生成PTT的化学方程式为 。
(3)请写出以有机物甲为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。
已知:
(合成路线常用的表示方式为:M N……
N…… 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A. | 稀盐酸 | Na2S | 漂粉精溶液 | 酸性:盐酸>氢硫酸>次氯酸 | |
B. | 浓盐酸 | KMnO4 | Na2S溶液 | 氧化性:KMnO4> Cl2>S | |
C. | 浓氨水 | NaOH | 酚酞 | 碱性:NaOH >NH3·H2O | |
D. | 浓硫酸 | Na2SO3 | BaCl2溶液 | SO2与可溶性钡盐均不反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
(14分)偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 ( L )+2N2O4 (L )=2CO2 (g)+3N2(g)+4H2O(g) (Ⅰ)
(1)该反应(Ⅰ)中还原剂是__________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
一定温度下,反应(Ⅱ)的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.

若在相同温度下,上述反应改在体积为3L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应4s后N2O4的物质的量为0.9mol,则0~4s内的平均反应速率v(NO2)=_________________。
(3)25℃时,将1mol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将_______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为____mol·L-1。(NH3·H2O的电离平衡常数K=2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是

A.通入N2的电极发生的电极反应式为:N2 + 6e- + 8H+== 2NH4+
B.反应过程中溶液的pH会变大,故需要加入盐酸
C.该电池外电路电流从通入H2的电极流向通入N2的电极
D.通入H2的电极为负极,A为NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省深圳市南山区上学期高一化学期末试卷(解析版) 题型:实验题
(14分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。试回答下列问题:

(1)装置A中发生反应的化学方程式为 。
(2)装置C盛放的药品是 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用 方式加热。
(5)F装置中干燥管内所装物质的作用是 。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
(7)在配制一定物质的量浓度的盐酸溶液时,下列操作所配溶液浓度偏低的是 :
A.配制溶液时,容量瓶中有少量水。
B.使用容量瓶配制溶液时,俯视观察溶液凹液面与容量瓶刻度线相切
C.配制好溶液后,容量瓶未塞好,洒出一些溶液。
D.发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com