
【题目】取含HCl和MgSO4的混合溶液1L,逐滴加入1molL﹣1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图,请回答下列问题:
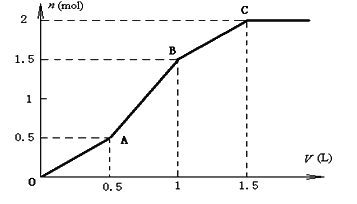
(1)OA段生成沉淀的化学式为______;
(2)AB段生成沉淀的离子方程式为:______;
(3)原溶液中的c(HCl)=______molL﹣1.
【答案】BaSO4 Ba2++SO42﹣=BaSO4↓、Mg2++2OH﹣=Mg(OH)2↓ 1
【解析】
含HCl和MgSO4的混合溶液中加入Ba(OH)2后,首先发生反应Ba2++SO42﹣=BaSO4↓,生成既不溶于水又不溶于酸的BaSO4沉淀,同时OH﹣跟H+发生中和反应:OH﹣+H+=H2O,OA段生成沉淀为BaSO4,HCl反应完毕,该阶段消耗n[Ba(OH)2]=0.5L×1mol/L=0.5mol,则n(HCl)=2n[Ba(OH)2]=1mol;
AB短生成沉淀量大于OA段,说明OA段Mg2+未反应,SO42﹣部分反应,继续加入Ba(OH)2,发生反应Ba2++SO42﹣=BaSO4↓、Mg2++2OH﹣=Mg(OH)2↓;
BC段生成沉淀量小于AB段,说明AB段中Mg2+完全反应,SO42﹣有剩余,再继续加入Ba(OH)2溶液,发生反应Ba2++SO42﹣=BaSO4↓,沉淀的量继续增大。
含HCl和MgSO4的混合溶液中加入Ba(OH)2后,首先发生反应Ba2++SO42﹣=BaSO4↓,生成既不溶于水又不溶于酸的BaSO4沉淀,同时OH﹣跟H+发生中和反应:OH﹣+H+=H2O,OA段生成沉淀为BaSO4,HCl反应完毕,该阶段消耗n[Ba(OH)2]=0.5L×1mol/L=0.5mol,则n(HCl)=2n[Ba(OH)2]=1mol;
AB短生成沉淀量大于OA段,说明OA段Mg2+未反应,SO42﹣部分反应,继续加入Ba(OH)2,发生反应Ba2++SO42﹣=BaSO4↓、Mg2++2OH﹣=Mg(OH)2↓;
BC段生成沉淀量小于AB段,说明AB段中Mg2+完全反应,SO42﹣有剩余,再继续加入Ba(OH)2溶液,发生反应Ba2++SO42﹣=BaSO4↓,沉淀的量继续增大。
(1)由上述分析可知,OA段生成沉淀的化学式为BaSO4;
(2)由上述分析可知,AB段生成沉淀的离子方程式为:Ba2++SO42﹣=BaSO4↓、Mg2++2OH﹣=Mg(OH)2↓;
(3)原溶液中的c(HCl)=![]() =1molL﹣1。
=1molL﹣1。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是
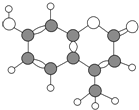
(1)分子式为C10H9O3(2)不能溶于水
(3)1mol该物质最多能与4molH2加成(4)能使酸性KMnO4溶液褪色
(5) 1mol该物质最多能与含2molNaOH的溶液反应.
A. (1)(2)(3)(4) B. (2)(4)(5)
C. (2)(3)(4) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可再生能源是我国重要的能源资源,在满足能源需求、改善能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能减排的一项重要措施。下列有关分析不正确的是( )
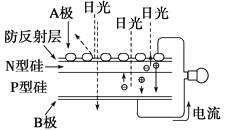
A.如上图是太阳能光伏发电原理图,图中A极为正极
B.风能、太阳能、生物质能等属于可再生能源
C.推广可再生能源有利于经济可持续发展
D.光伏发电能量转化方式是太阳能直接转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质![]() 括号内物质为杂质
括号内物质为杂质![]() ,所选用的试剂和分离方法都正确的是( )
,所选用的试剂和分离方法都正确的是( )
选项 | 物质 | 除杂试剂 | 分离方法或操作 |
A | 乙醇 | 无水 | 充分反应后蒸馏 |
B | 苯 | NaOH溶液 | 振荡静置后过滤 |
C | NaCl固体 | 水 | 高温溶解、降温结晶 |
D |
| 饱和 | 充分浸泡后过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 试分析比较合成氨与用SO2和O2反应制SO3的反应:
(1)某些相同点: ①△H ______ 0;②△S ______ 0(填<、=、>);③反应在 ______ 均能自发进行。
(2)条件选择中,主要的三方面不同点?并说明原因和理由?
①______;② ______;③______。
(3)请作出这类反应的“反应过程与能量变化”示意图________________________
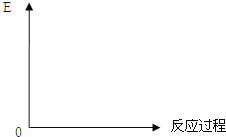
Ⅱ.(4)SO2处理的一种方法是用石灰吸收(“钙基固硫”),其最终生成 ______ (写名称);
(5)实验室里可用“在浓氨水中加生石灰”的方法制取氨气,其理由是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.HF、HCl、H2S、PH3的稳定性依次增强
B.按Mg、Si、N、F的顺序,原子半径由小变大
C.某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族
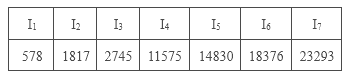
D.在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子排布式为3s23p4的粒子描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。SiO2的晶体类型为_____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是___________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A.甲烷和氯气在光照条件下反应的产物有5种
B.2—乙基—1,3—丁二烯分子的键线式:![]()
C.分子式为C5H12O2的二元醇的主链碳原子数为3的结构有2种
D.为检验氯丙烷中的氯元素,可将氯丙烷与NaOH溶液共热几分钟后,冷却,滴加AgNO3溶液,观察是否有白色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com