
����Ŀ����ͼ��ʾ��p��qΪֱ����Դ��������A�ɽ�������X�Ƴɣ�B��C��DΪ���缫����ͨ��Դ������X������B����ͬʱC��D�ϲ������ݣ��Իش� 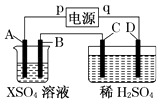
��1��pΪ����A����������Ӧ��
��2��CΪ�������ռ�����DΪ�������ռ��� ��
��3��C���ĵ缫��ӦʽΪ ��
��4���ڵ������У���C��D�����ϲ�������������ʵ�����������
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
������������������cm3�� | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
������������������cm3�� | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
��ϸ��������ʵ�����ݣ���˵���仯�Ŀ���ԭ���� ��
��5������Ӧ����һ��ʱ���A��B�缫������Һ��pH���������С�����䡱����
��6������·��ͨ��0.004mol����ʱ��B���ϳ����Ľ���XΪ0.128g����˽�����Ħ������Ϊ ��
���𰸡�
��1����������
��2��������������������
��3��4OH����4e��=O2��+2H2O
��4����ʼʱC��D�������������Ϊ1��3,10����ʱԼΪ1��2,˵����ʼʱ�����ܽ�����Һ��
��5������
��6��64g/mol
���������⣺��1����ͨ��Դ������X������B����ͬʱC��D�������ݣ���BΪ������X�����������ŵ����ɽ������ʣ���A��C��������B��D������������p��������A�缫��ʧ���ӷ���������Ӧ��
���Դ��ǣ�������������2��C�缫�ǵ������������������������ӷŵ磻DΪ���������ӷŵ��������������Դ��ǣ�����������������������3��C�����������������������ӷŵ������������缫��ӦʽΪ��4OH����4e��=O2��+2H2O��
���Դ��ǣ�4OH����4e��=O2��+2H2O����4��������������������ˮ������������������ˮ������1��6�����������������ܽ�Ŀ���࣬�Ӷ������������������ɵ��������֮�ȴ���2��1��
���Դ��ǣ���ʼʱC��D�������������Ϊ1��3��10����ʱԼΪ1��2��˵����ʼʱ�����ܽ�����Һ�У���5�����������Һʵ���ϵ�����ˮ�����һ��ʱ���A��B�缫������Һ��pH���䣬���Դ��ǣ����䣻��6������Ħ������ΪM�����ʱ��B�缫�ϵĵ缫��ӦʽΪX 2++2e��=X����
X2++ | 2e��= | X |
2mol | 1mol | |
0.004mol |
|
M= ![]() =64g/mol��
=64g/mol��
���Դ��ǣ�64g/mol��


 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����壮
��1��4CO��g��+2NO2��g���T4CO2��g��+N2��g����H=��1 200kJmol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ����������ţ���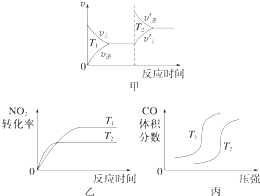
��2������β����CO��H2O��g����һ�������¿��Է�����Ӧ��
CO��g��+H2O��g��CO2��g��+H2��g����H��0��
820��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��K=1.0��
��ʼ���ʵ��� | �� | �� | �� |
n��H2O��/mol | 0.10 | 0.20 | 0.20 |
n��CO��/mol | 0.10 | 0.10 | 0.20 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��ƽ��ʱ����������CO��ת������ �� �Ƚ�����������CO��ת���ʣ����ף����ף����������=����������
�۱������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת�����������¶�������ߡ����͡�����ƽ�ⳣ��K�����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±�����ش�
ʵ���� | HA���ʵ���Ũ�� | NaOH���ʵ���Ũ�� | �����Һ��pH |
�� | 0.2 | 0.2 | pH=a |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH��7 |
�� | 0.1 | 0.1 | pH=9 |
��1���������������ʵ���������Ӽ�����������������a �������Һ��pH����˵��HA��ǿ�ỹ������ ��
��2���������������ʵ�����������������������C�Ƿ�һ������0.2��ѡ��ǡ��������Һ������Ũ��c��A������ c��Na+���Ĵ�С��ϵ�� ��
��3������ʵ����������HA���ᣨѡ�ǿ�������������û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c��OH����=molL��1 �� д���û����Һ��������ʽ�ľ�ȷ��������������Ƽ��㣩��c��Na+����c��A����=molL��1 c��OH������c��HA��=molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�ӵĺ�������Ų�ʾ��ͼ����ͼ��ʾ������ԭ���У����Ԫ��ԭ�ӵĻ�ѧ�������Ƶ���

A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ֶ�����Ԫ���γɵ����嵥��X��Y��Z����������ת����ϵ(��Ӧ��������ȥ)����֪��X�����к����ۼ���ࣻ�����к�10�����ӣ��ҷ��Ӻ���18�����ӡ�

(1)д������X�Ľṹʽ��________________________________________________��
(2)������ĵ���ʽ��_____________________________����ˮ��Һ��________ �ԡ�
(3)��������д��ڵĻ�ѧ����____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ�������Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ�����и������У�������ʵ�������ǣ�������
A.ȡ����ྻ����ʽ�ζ�������װ�������
B.������ˮϴ����ƿ������װ��һ�������NaOH��Һ����еζ�
C.��ʢ��20.00mL NaOH��Һ����ƿ�У����뼸�η�ָ̪ʾ������еζ�
D.������ˮϴ����ƿ������NaOH��Һ��ϴ��Ȼ��װ��һ�������NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ۼ������Ӽ��ͷ��Ӽ����������ǹ������ʻ����ʱ���Ӽ�������������������У�ֻ�������Ӽ�����
A.�ɱ�B.�Ȼ���C.��������D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪N2O4(��ɫ)![]() 2NO2(����ɫ) ��������ͼ��ʾ��������ƿ,�ֱ����NO2���岢�ֱ������ʢ���������ʵ��ձ�(�ձ�����ˮ)�У�����I���м�����ˮCaO������III���м���NH4Cl���壬��II���в��������κ����ʣ�������I���к���ɫ�����III���к���ɫ��dz������������ȷ���� (�� ��)
2NO2(����ɫ) ��������ͼ��ʾ��������ƿ,�ֱ����NO2���岢�ֱ������ʢ���������ʵ��ձ�(�ձ�����ˮ)�У�����I���м�����ˮCaO������III���м���NH4Cl���壬��II���в��������κ����ʣ�������I���к���ɫ�����III���к���ɫ��dz������������ȷ���� (�� ��)

A. CaO����ˮʱ�������� B. �÷�Ӧ����H>0
C. NH4Cl����ˮʱ�ų����� D. ��ƿ(III)�������ѹǿ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com