
【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.
(1)4CO(g)+2NO2(g)═4CO2(g)+N2(g)△H=﹣1 200kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号).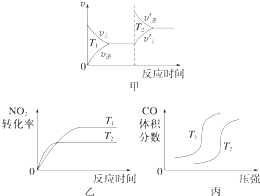
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.
820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0.
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为 .
②平衡时,甲容器中CO的转化率是 . 比较下列容器中CO的转化率:乙甲;丙甲(填“>”、“=”或“<”).
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度(填“升高”或“降低”),平衡常数K(填“增大”、“减小”或“不变”).
【答案】
(1)乙
(2)= ![]() ,50%,>,=,降低,增大
,50%,>,=,降低,增大
【解析】解:(1)该反应为放热反应,升高温度,正逆反应速率均增大,都应该离开原来的速率点,图象与实际情况不相符,故甲错误;
升高温度,反应向着逆向进行,反应物的转化率减小,反应速率加快,图象与实际反应一致,故乙正确,
压强相同时,升高温度,反应向着逆向移动,一氧化氮的体积分数应该增大,图象与实际不相符,故丙错误,
所以答案是:乙;(2)①CO(g)+H2O(g)CO2(g)+H2(g),该反应的平衡常数表达式为:K═ ![]() ,
,
所以答案是:K= ![]() ;
;
②设甲容器中CO消耗的物质的量为x,
CO(g)+ | H2O(g) | CO2(g)+ | H2(g) | |
起始 | 0.1 | 0.1 | 0 | 0 |
转化 | x | x | x | x |
平衡 | 0.1-x | 0.1-x | x | x |
则K= ![]() =1,
=1,
解得x=0.5,所以甲容器中CO的转化率= ![]() ×100%=50%;
×100%=50%;
根据投料情况知道,乙相当于在甲的基础上增加了水蒸气的投料,所以会使得一氧化碳的转化率增大,丙装置投料是甲装置的2倍,对于化学反应前后系数和不变的反应来说,建立的平衡是等效的,所以两种情况下,转化率是相等的,
所以答案是:50%;>;=;
③丙容器中,通过改变温度,使CO的平衡转化率增大,需要使化学平衡向着正向移动,由于该反应为放热反应,要增大一氧化碳的转化率,应该降低温度;由于平衡向着正向移动,反应物浓度减小,生成物浓度增大,则该反应的化学平衡常数增大,
所以答案是:降低;增大.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑,用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑,用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
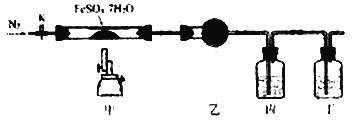
A. 乙、丙、丁中可依次盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,某课外学习小组设计了如下装置制取氯气并验证氯气的某些性质。

请回答:
(1)装置A中仪器a的名称为____________________。制取氯气的化学反应方程式为_____________________________________。
(2)装置B中饱和食盐水的作用是_______________________________。
(3)装置C中浓硫酸的作用是_______________________________。
(4)实验进行一段时间后,可观察到装置D中的干燥的有色布条__________________,其原因是_____________________________。
(5)装置E的烧杯中是_______________溶液,其作用是_____________________。其反应的化学方程式为____________________________________________________。
(6)若生成标准状况下2.24L Cl2,则参加反应的HCl物质的量为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况),假设电解后溶液的体积仍为500mL.下列说法正确的是( )
A.原混合溶液中K+的物质的量浓度为1 mol/L
B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中H+的物质的量浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料, 其有关制备途径及性质如图所示,其中混合气体 X中含有SO2、SO3。下列说法不正确的是

A. 途径①所用混酸中 H2SO4与 HNO3物质的量之比最好为 3∶2
B. 相对于途径①、 ③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在 1100℃所得混合气体X中O2为 0.75 mol
D. Y 可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法错误的是

A. M点溶液中c(A-)等于N点溶液中c(B-)
B. HA的电离常数约为10-4
C. 浓度均为0.1mol/L的NaA和HA混合溶液的pH<7
D. M、P两点的溶液分别用等浓度的NaOH溶液中和,消耗的NaOH溶液体积:P>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 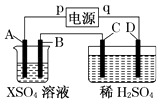
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com