
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ�ij����ѧϰС�����������װ����ȡ��������֤������ijЩ���ʡ�

��ش�
��1��װ��A������a������Ϊ____________________����ȡ�����Ļ�ѧ��Ӧ����ʽΪ_____________________________________��
��2��װ��B�б���ʳ��ˮ��������_______________________________��
��3��װ��C��Ũ�����������_______________________________��
��4��ʵ�����һ��ʱ��ɹ۲쵽װ��D�еĸ������ɫ����__________________����ԭ����_____________________________��
��5��װ��E���ձ�����_______________��Һ����������_____________________���䷴Ӧ�Ļ�ѧ����ʽΪ____________________________________________________��
��6�������ɱ�״����2.24L Cl2����μӷ�Ӧ��HCl���ʵ���Ϊ____________mol��
���𰸡� ��Һ©�� MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O ��ȥ�����е�HCl���� ��ȥ�����е�ˮ����������������� û�����Ա仯������ɫ�� ���������û��Ư���� NaOH��Һ ���չ��������� 2NaOH+Cl2=NaCl+NaClO+H2O 0.4mol
MnCl2+Cl2��+2H2O ��ȥ�����е�HCl���� ��ȥ�����е�ˮ����������������� û�����Ա仯������ɫ�� ���������û��Ư���� NaOH��Һ ���չ��������� 2NaOH+Cl2=NaCl+NaClO+H2O 0.4mol
����������1���������������ж����ƣ�ʵ�������ö������̺�Ũ�����ڼ����������Ʊ�������
��2������ʳ��ˮ��ȥ�Ȼ��⣻
��3������Ũ���������ˮ���жϣ�
��4������û��Ư���ԣ�
��5�������ж���Ҫβ��������
��6���������������ʵ�����Ϸ���ʽ���㡣
��1��װ��A������a������Ϊ��Һ©����ʵ�������ö������̺�Ũ�����ڼ����������Ʊ�����������ȡ�����Ļ�ѧ��Ӧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2�����ɵ������к����Ȼ��⣬���װ��B�б���ʳ��ˮ�������dz�ȥ�����е�HCl���塣
��3��Ũ���������ˮ�ԣ����ɵ������к���ˮ��������װ��C��Ũ����������dz�ȥ�����е�ˮ�������������������
��4������û��Ư���ԣ���ˮ��Ӧ���ɵĴ��������Ư���ԣ����ʵ�����һ��ʱ��ɹ۲쵽װ��D�еĸ������ɫ����û�����Ա仯������ɫ������ԭ���Ǹ��������û��Ư���ԡ�
��5�������ж���Ҫβ��������һ���ü�Һ���ն������������װ��E���ձ�����NaOH��Һ�������������չ������������䷴Ӧ�Ļ�ѧ����ʽΪ2NaOH+Cl2=NaCl+NaClO+H2O��
��6�������ɱ�״����2.24L Cl2�����������ʵ�����0.1mol�����ݷ���ʽMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��֪�μӷ�Ӧ��HCl���ʵ���Ϊ0.4mol��
MnCl2+Cl2��+2H2O��֪�μӷ�Ӧ��HCl���ʵ���Ϊ0.4mol��


 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�͵��Ļ������������������й㷺���ڡ���ش��������⣺
��1��������ʾ�����ô������ƴ�����ˮ�еİ���(NH3)��ʹ��ת��Ϊ������ȥ������Ҫ��Ӧ����
I.NH3(aq)+ HClO(aq)= NH2 Cl(aq)+H2O(1)
II. 2NH2 Cl(aq)+HClO(aq)=N2(g) +H2O(1)+3HCl(aq)
�����Ϸ�Ӧ��HClO����Դ�û�ѧ���������__________________________________
��ʵ����.��ˮ��pH�백��ȥ���ʵĹ�ϵ��ͼ��ʾ��pH�ϸ�ʱ������ȥ�����½���ԭ����____________________________________
 c
c
��2����ø����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�Ʊ��״����йط�Ӧ�Ļ�ѧ����ʽ�����ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�����±���ʾ��

�����д�ʩ��ʹ��Ӧ�۵�ƽ����ϵ��![]() �������________(����ĸ����)��
�������________(����ĸ����)��
A.��H2O(g)����ϵ�з����ȥ B.����He(g)��ʹ��ϵѹǿ����
C.�����¶� D.����ʱ�ٳ���1mol H2 (g)
��500��ʱ��÷�Ӧ����ijʱ��H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ�ȷքeΪ0.8mol��L-1��0.1mol��L-1��0.3mol��L-1��0.15mol��L-1�����ʱv(��) ________ (�>�� ��=����<��) v (��)
��3�������£���(NH4)2C2O4��Һ������ӦNH4++C2O42-+H2O ![]() NH3��H2O+HC2O4���Ļ�ѧƽ�ⳣ��K=____________��(��֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2C2O4�ĵ���ⳣ��Ka1=5��10-2��Ka2=5��10-5)
NH3��H2O+HC2O4���Ļ�ѧƽ�ⳣ��K=____________��(��֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2C2O4�ĵ���ⳣ��Ka1=5��10-2��Ka2=5��10-5)
��4�����������ҵ��β��NO���Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ��

�������ĵ缫��ӦʽΪ____________________________________
�ڽ�������ɵ�HNO3ȫ��ת��ΪNH4NO3����ͨ���NH3��ʵ�ʲμӷ�Ӧ��NO�����ʵ���֮������Ϊ_________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ����Na+��Fe3+��Cl-��SO42-�е�2���������ֱ�ȡ����Һ����������ʵ����
��1������Һ�еμ��������ữ��AgNO3��Һ���а�ɫ����������
��2������Һ�еμ�Ba(NO3)2��Һ��û���κ�����
��������ʵ��������ȷ����Һ��һ�����ڵ�������
A��Fe3+��Cl- B. Na+��SO42- C. Fe3+ ��SO42- D. Na+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ⱦɫ���Ⱦɫ�ʵ���Ҫ������ �� ��
A. DNA��RNA B. DNA�͵�����
C. RNA�͵����� D. ��֬��DNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ԭ�ӵĽṹʾ��ͼΪ_____________________��
��2��![]() �����������_______����������_______�������������_______��
�����������_______����������_______�������������_______��
��3��49g ��������ʵ���Ϊ________mol������ȫ�������H+�ĸ���Ϊ___________��
��4��V L Al2(SO4)3��Һ�У�����a g Al3+������Һ��Al3+�����ʵ���Ũ��_________��SO42 ���ʵ���Ũ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=1����������ҺA��B��1mL���ֱ��ˮϡ�͵�1000mL����pH����Һ����Ĺ�ϵ��ͼ������˵����ȷ���ǣ������� ����a��4����A��B ��������
��ϡ�ͺ�A����Һ�����Ա�B����Һǿ
����a=4����A��ǿ�ᣬB������
��A��B��������Һ�����ʵ���Ũ��һ����ȣ�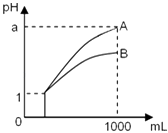
A.�٢�
B.�ڢ�
C.�٢�
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����壮
��1��4CO��g��+2NO2��g���T4CO2��g��+N2��g����H=��1 200kJmol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ����������ţ���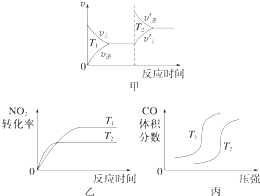
��2������β����CO��H2O��g����һ�������¿��Է�����Ӧ��
CO��g��+H2O��g��CO2��g��+H2��g����H��0��
820��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��K=1.0��
��ʼ���ʵ��� | �� | �� | �� |
n��H2O��/mol | 0.10 | 0.20 | 0.20 |
n��CO��/mol | 0.10 | 0.10 | 0.20 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��ƽ��ʱ����������CO��ת������ �� �Ƚ�����������CO��ת���ʣ����ף����ף����������=����������
�۱������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת�����������¶�������ߡ����͡�����ƽ�ⳣ��K�����������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڽ����������ǣ� ��
A. �˵��в˺�ϴ���ͷŻص���
B. �������Ƴɲ����
C. �������ı�������һ������
D. ���ڵ��µĸֹ���п������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�ӵĺ�������Ų�ʾ��ͼ����ͼ��ʾ������ԭ���У����Ԫ��ԭ�ӵĻ�ѧ�������Ƶ���

A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com