
【题目】(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g 硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42 物质的量浓度__________________。
【答案】 ![]() 16 18 18 0.5 6.02×1023或NA
16 18 18 0.5 6.02×1023或NA ![]() mol/L
mol/L ![]() mol/L
mol/L
【解析】(1)氯原子的原子序数是17,据此书写结构示意图;
(2)根据质子数+中子数=质量数以及质子数与核外电子数的关系解答;
(3)根据n=m/M以及硫酸是二元强酸计算;
(4)根据c=n/V计算。
(1)氯原子的原子序数是17,其结构示意图为![]() 。
。
(2)![]() 的质子数是16,中子数是34-16=18,核外电子数是16+2=18。
的质子数是16,中子数是34-16=18,核外电子数是16+2=18。
(3)49g 硫酸的物质的量为49g÷98g/mol=0.5mol,硫酸是二元强酸,其完全电离产生H+的物质的量是0.5mol×2=1mol,个数为6.02×1023或NA。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,铝离子的物质的量是![]() ,则溶液中Al3+的物质的量浓度为
,则溶液中Al3+的物质的量浓度为![]() ;根据化学式可知SO42物质的量浓度为
;根据化学式可知SO42物质的量浓度为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将盐酸逐滴加入到氨水中 ,发生反应的离子方程式正确的是( )
A. OH—+H+ → H2O B. H+ + NH3H2O → NH4+ + H2O
C. HCl+OH—→Cl—+H2O D. HCl+NH3H2O→Cl—+NH4++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( ) 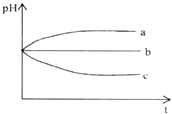
A.H2S溶液、稀H2SO4溶液、H2SO3溶液
B.氯水、稀HNO3溶液、NH4Cl溶液
C.H2SO3溶液、稀HCl溶液、氯水
D.H2S溶液、浓盐酸、H2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种物质:①氯气;②二氧化硫;③稀硫酸;④铁;⑤BaCl2固体;⑥氢氧化钾;⑦KNO3溶液;⑧酒精(C2H5OH);⑨氧化钙,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:属于酸性氧化物的有_________________,属于碱性氧化物的有___________________,属于电解质的是________,属于非电解质的是__________。(用相应化学式填空)
(2)按要求完成下列方程式:
① 盐与酸反应_________________________________,
② 氧化物与碱溶液反应_________________________________,
③ 属于氧化还原反应的化合反应_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,某课外学习小组设计了如下装置制取氯气并验证氯气的某些性质。

请回答:
(1)装置A中仪器a的名称为____________________。制取氯气的化学反应方程式为_____________________________________。
(2)装置B中饱和食盐水的作用是_______________________________。
(3)装置C中浓硫酸的作用是_______________________________。
(4)实验进行一段时间后,可观察到装置D中的干燥的有色布条__________________,其原因是_____________________________。
(5)装置E的烧杯中是_______________溶液,其作用是_____________________。其反应的化学方程式为____________________________________________________。
(6)若生成标准状况下2.24L Cl2,则参加反应的HCl物质的量为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况),假设电解后溶液的体积仍为500mL.下列说法正确的是( )
A.原混合溶液中K+的物质的量浓度为1 mol/L
B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中H+的物质的量浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料, 其有关制备途径及性质如图所示,其中混合气体 X中含有SO2、SO3。下列说法不正确的是

A. 途径①所用混酸中 H2SO4与 HNO3物质的量之比最好为 3∶2
B. 相对于途径①、 ③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在 1100℃所得混合气体X中O2为 0.75 mol
D. Y 可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。下列说法中正确的是( )

A. 阳极的电极反应式为2Cl--2e-===Cl2↑ B. 阴极的电极反应式为TiO2+4e-===Ti+2O2-
C. 通电后,O2-、Cl-均向阴极移动 D. 石墨电极的质量不发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com