
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( ) ①若a<4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.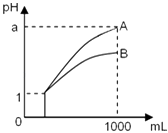
A.①④
B.②③
C.①③
D.②④
【答案】C
【解析】解:①pH=1的酸,加水稀释到1000倍,若pH=4,为强酸,若a<4,则A、B 都是弱酸,故①正确;
②由图可知,B的pH小,c(H+)大,则B酸的酸性强,故②错误;
③由图可知,若a=4,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故③正确;
④因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,故④错误;
故选C.
【考点精析】根据题目的已知条件,利用弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素 Y 的原子获得 3 个电子或元素 X 的原子失去 2 个电子后,它们的电子层结构都与氖原子的电子层结构相同。X、Y 两种元素的单质在高温下反应得到的化合物的化学式是
A.Y3X2B.X2Y3C.X3Y2D.Y2X3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,某课外学习小组设计了如下装置制取氯气并验证氯气的某些性质。

请回答:
(1)装置A中仪器a的名称为____________________。制取氯气的化学反应方程式为_____________________________________。
(2)装置B中饱和食盐水的作用是_______________________________。
(3)装置C中浓硫酸的作用是_______________________________。
(4)实验进行一段时间后,可观察到装置D中的干燥的有色布条__________________,其原因是_____________________________。
(5)装置E的烧杯中是_______________溶液,其作用是_____________________。其反应的化学方程式为____________________________________________________。
(6)若生成标准状况下2.24L Cl2,则参加反应的HCl物质的量为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温条件下,Al和Fe3O4反应生成Fe和Al2O3。下列说法正确的是

A. 该反应过程中的能量变化如图所示
B. 该反应条件下,Al的还原性弱于Fe
C. 1molFe3O4参与反应转移8×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年,美国麻省理工学院的唐纳德·撒多维教授领导的小组研制出一种镁一锑液态金属储能电池。该电池工作温度为700摄氏度,其工作原理如图所示:

该电池所用液体密度不同,在重力作用下分为三层,充放电时中间层熔融盐的组成及浓度不变。下列说法正确的是
A. 该电池放电时,正极反应式为Mg2+-2e-=Mg
B. 该电池放电时,Mg(液)层生成MgCl2,质量变大
C. 该电池充电时,Mg-Sb(液)层中Mg发生氧化反应
D. 该电池充电时,熔融盐中的Cl-进入Mg-Sb(液)层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com