
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

【答案】 放热 B 放出 46 ③ Cu2++2e-=Cu 3
【解析】(1)浓度越小,反应速率越小,温度越高,速率越大;放热反应中,反应物的总能量大于生成物的总能量,吸热反应中,反应物的总能量小于生成物的总能量;结合金属与酸的反应为放热反应分析;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算反应热并判断吸热还是放热;
(3)根据原电池原理判断正负极和电极反应。
详解:(1)在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量,则图象B正确,因此,本题正确答案是:放热;B;
(2)在反应2NH3![]() N2+3H2中,断裂2molNH3共形成6molN-H键,吸收的能量为:6×391kJ=2346kJ,生成3molH-H键,1molN≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ-2254kJ=92kJ,所以当1molNH3分解吸收热量为92kJ;
N2+3H2中,断裂2molNH3共形成6molN-H键,吸收的能量为:6×391kJ=2346kJ,生成3molH-H键,1molN≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ-2254kJ=92kJ,所以当1molNH3分解吸收热量为92kJ;
因此,本题正确答案是:吸收;46。
(3)①中铜是负极,碳是正极,铁离子在正极放电生成亚铁离子,不能比较Fe2+与Cu2+氧化性强弱;②中常温下铁与浓硝酸发生钝化,铁是正极,铜是负极,不能比较Fe2+与Cu2+氧化性强弱;③中铁是负极,碳是正极,铜离子在正极得电子得到电子生成铜,能比较Fe2+与Cu2+氧化性强弱,正极的电极反应为Cu2++2e-=Cu。当导线中通过0.05mol电子时,消耗铁0.025mol×56g/mol=1.4g,析出铜是0.025mol×64g/mol=1.6g,两个电极的质量差为1.4g+1.6g=3g。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单阳离子半径:X>R
B. X与Y可以形成正四面体结构的分子
C. M的氢化物常温常压下为液体
D. 最高价氧化物对应水化物的酸性:Z<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液含有Na+、Fe3+、Cl-、SO42-中的2种离子,分别取该溶液进行了下列实验:
(1)向溶液中滴加用硝酸酸化的AgNO3溶液,有白色沉淀产生;
(2)向溶液中滴加Ba(NO3)2溶液,没有任何现象。
根据上述实验,可以确定溶液中一定存在的离子是
A.Fe3+和Cl- B. Na+和SO42- C. Fe3+ 和SO42- D. Na+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定不正确的是 ( )
A. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,可能有Ba2+
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,不一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH![]()
D. 通过焰色反应观察到火焰为黄色,则一定含有钠元素,一定不含钾元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( ) ①若a<4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.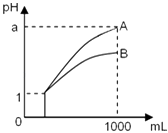
A.①④
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醚(CH3CH2OCH2CH3)曾经用作麻醉剂,实验室中可将乙醇、浓硫酸的混合液加热至 140℃制取一定量的乙醚,制备原理、装置、有关物质的部分性质如下(夹持装置、加热仪器和沸石均略去):
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O

沸点/℃ | 水溶性 | 密度(g/mL) | |
乙醇 | 78 | 混溶 | 0.8 |
乙醚 | 34.6 | 难溶 | 0.7 |
回答下列问题:
(1)温度计 X 的水银球应位于_____________________。
(2)使用仪器 B 与不使用仪器 B 相比,其优点是_____________________。
(3)所得到的乙醚中含有一定量的乙醇及酸性物质。为得到高纯度的乙醚,可依次用NaOH 溶液、水洗涤;然后用无水 CaCl2干燥,最后进行蒸馏精制。
① 洗涤操作应在_____________(填仪器名称)中进行。
② 蒸馏精制时,最好的加热方式是________________________。
③ 若实验中使用了57.5mL 无水乙醇, 最后得到乙醚 18.0mL,则乙醚的产率为_____。
(4)实验中,发现 A 中的液体会变黑; E 中的溶液会逐渐褪色,加热后又会变红。
① A 中溶液颜色变黑的原因是________________________
②乙醇、浓硫酸的混合液在加热条件下会有副反应发生,生成两种常见的无机气体,该副反应的化学方程式为______________________。
(5)要证明该反应中有 CO2生成,在 F 后面连接一个盛有澄清石灰水的洗气瓶,并将F中的液体改为______溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com