
����Ŀ��̼�͵��Ļ������������������й㷺���ڡ���ش��������⣺
��1��������ʾ�����ô������ƴ�����ˮ�еİ���(NH3)��ʹ��ת��Ϊ������ȥ������Ҫ��Ӧ����
I.NH3(aq)+ HClO(aq)= NH2 Cl(aq)+H2O(1)
II. 2NH2 Cl(aq)+HClO(aq)=N2(g) +H2O(1)+3HCl(aq)
�����Ϸ�Ӧ��HClO����Դ�û�ѧ���������__________________________________
��ʵ����.��ˮ��pH�백��ȥ���ʵĹ�ϵ��ͼ��ʾ��pH�ϸ�ʱ������ȥ�����½���ԭ����____________________________________
 c
c
��2����ø����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�Ʊ��״����йط�Ӧ�Ļ�ѧ����ʽ�����ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�����±���ʾ��

�����д�ʩ��ʹ��Ӧ�۵�ƽ����ϵ��![]() �������________(����ĸ����)��
�������________(����ĸ����)��
A.��H2O(g)����ϵ�з����ȥ B.����He(g)��ʹ��ϵѹǿ����
C.�����¶� D.����ʱ�ٳ���1mol H2 (g)
��500��ʱ��÷�Ӧ����ijʱ��H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ�ȷքeΪ0.8mol��L-1��0.1mol��L-1��0.3mol��L-1��0.15mol��L-1�����ʱv(��) ________ (�>�� ��=����<��) v (��)
��3�������£���(NH4)2C2O4��Һ������ӦNH4++C2O42-+H2O ![]() NH3��H2O+HC2O4���Ļ�ѧƽ�ⳣ��K=____________��(��֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2C2O4�ĵ���ⳣ��Ka1=5��10-2��Ka2=5��10-5)
NH3��H2O+HC2O4���Ļ�ѧƽ�ⳣ��K=____________��(��֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2C2O4�ĵ���ⳣ��Ka1=5��10-2��Ka2=5��10-5)
��4�����������ҵ��β��NO���Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ��

�������ĵ缫��ӦʽΪ____________________________________
�ڽ�������ɵ�HNO3ȫ��ת��ΪNH4NO3����ͨ���NH3��ʵ�ʲμӷ�Ӧ��NO�����ʵ���֮������Ϊ_________________________________
���𰸡� ClO-+H2O![]() HClO+OH- pH�ϴ�ʱ,c(OH-)�ϴ�������NaClOˮ����c(HClO)��С��������������,����ȥ���ʽ��� AD > 1��10-5 NO+5e-+6H+=NH4++H2O 1:4
HClO+OH- pH�ϴ�ʱ,c(OH-)�ϴ�������NaClOˮ����c(HClO)��С��������������,����ȥ���ʽ��� AD > 1��10-5 NO+5e-+6H+=NH4++H2O 1:4
����������1���ٴ����������ˮ����������ᣬ��Һ�ʼ��ԣ�ˮ�ⷴӦ����ʽΪClO-+H2O![]() HClO+OH-����pH�ϴ�ʱ,c(OH-)�ϴ�������NaClOˮ����c(HClO)��С��������������,����ȥ���ʽ��ͣ���2����Ҫʹ��ϵ��
HClO+OH-����pH�ϴ�ʱ,c(OH-)�ϴ�������NaClOˮ����c(HClO)��С��������������,����ȥ���ʽ��ͣ���2����Ҫʹ��ϵ��![]() ����Ӧʹƽ��������Ӧ�����ƶ���A����H2O��g������ϵ�з��룬ƽ��������Ӧ�����ƶ���
����Ӧʹƽ��������Ӧ�����ƶ���A����H2O��g������ϵ�з��룬ƽ��������Ӧ�����ƶ���![]() ����ѡ��A��ȷ��B������He��g����ʹ��ϵѹǿ�����Է�Ӧ������˵��Ũ��û�б仯��ƽ�ⲻ�ƶ���
����ѡ��A��ȷ��B������He��g����ʹ��ϵѹǿ�����Է�Ӧ������˵��Ũ��û�б仯��ƽ�ⲻ�ƶ���![]() ���䣬ѡ��B����C��������Ӧ���ȣ������¶�ƽ�����淴Ӧ�����ƶ�����
���䣬ѡ��B����C��������Ӧ���ȣ������¶�ƽ�����淴Ӧ�����ƶ�����![]() ��С��ѡ��C����D������ʱ�ٳ���1mol H2 (g)��������̼��ת��������ƽ��������Ӧ�����ƶ������ɼ״����࣬��
��С��ѡ��C����D������ʱ�ٳ���1mol H2 (g)��������̼��ת��������ƽ��������Ӧ�����ƶ������ɼ״����࣬��![]() ����ѡ��D��ȷ����ѡAD�����ɸ�˹���ɿ�֪���ɢ�+�ڿɵ÷�Ӧ�ۣ���500��ʱ��3����1K2=2.5
����ѡ��D��ȷ����ѡAD�����ɸ�˹���ɿ�֪���ɢ�+�ڿɵ÷�Ӧ�ۣ���500��ʱ��3����1K2=2.5![]() ����÷�Ӧ����ijʱ��H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ�ȷ�Ϊ0.8mol��L-1��0.1mol��L-1��0.3mol��L-1��0.15mol��L-1�����ʱQ=
����÷�Ӧ����ijʱ��H2(g)��CO2(g)��CH3OH(g)��H2O(g)��Ũ�ȷ�Ϊ0.8mol��L-1��0.1mol��L-1��0.3mol��L-1��0.15mol��L-1�����ʱQ=![]() ��ƽ�������ƶ���v (��) > v (��)����3�������£���ӦNH4++C2O42-+H2O
��ƽ�������ƶ���v (��) > v (��)����3�������£���ӦNH4++C2O42-+H2O ![]() NH3��H2O+HC2O4���Ļ�ѧƽ�ⳣ��K=
NH3��H2O+HC2O4���Ļ�ѧƽ�ⳣ��K= ����4������ͼʾ��֪��NO�������ϵõ�������笠����ӣ��缫��ӦʽΪNO+5e-+6H+=NH4++H2O��NO��������ʧ��������NO3-���缫��ӦʽΪNO-3e-+2H2O= NO3-+4H+������ܷ�ӦʽΪ8NO+ H2O
����4������ͼʾ��֪��NO�������ϵõ�������笠����ӣ��缫��ӦʽΪNO+5e-+6H+=NH4++H2O��NO��������ʧ��������NO3-���缫��ӦʽΪNO-3e-+2H2O= NO3-+4H+������ܷ�ӦʽΪ8NO+ H2O ![]() NH4NO3+2HNO3���ʵ�ʵ�ʲμӷ�Ӧ��NOΪ8molʱ��Ҫ��������ɵ�����ȫ��ת��Ϊ����泥���Ӧͨ��2mol NH3����n(NH3): (NO )=2mol:8mol=1:4��
NH4NO3+2HNO3���ʵ�ʵ�ʲμӷ�Ӧ��NOΪ8molʱ��Ҫ��������ɵ�����ȫ��ת��Ϊ����泥���Ӧͨ��2mol NH3����n(NH3): (NO )=2mol:8mol=1:4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ����Ӧ����ʽ����ƽ����Cu+2H2SO4(Ũ)![]() CuSO4+A��+2H2O����ͨ����������������������⣺
CuSO4+A��+2H2O����ͨ����������������������⣺
��1��A���ʿ��Ե���������γɡ���AӦ������________������ĸ������д��
a. �� b. �� c. �� d. ���������� e. ����������
A���ʿ���ʹ����KMnO4��Һ��ɫ���˷�Ӧ��________����д��ѧʽ����ͬ��ʧȥ���ӣ���������__________��
��2��һ������ͭƬ��100mL 18 mol/L��ŨH2SO4��ַ�Ӧ������÷�Ӧ������ת����0.2mol���ӣ����ɵ�CuSO4������Ϊ_____g�����ɵ�A�����ڱ�״�������Ϊ_____L����������ȫ���ݳ�����ʣ���H2SO4��Ũ��Ϊ____________mol/L��������Һ����ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����̼����ﴦ����CuSO4��ˮ��ý���ͭ�����ݳ���м�ͻ���̿����������ʱ����÷�ˮ��Cu2+Ũ���ڲ�ͬ��̼������(x)��������ʱ�ʱ仯��������ͼ��ʾ���������۲���������

A. ��ͼ��֪������̿��Cu2+����һ������������
B. ��м�ͻ���̿������Һ���γ���أ���мΪ����
C. ������̼�������պ�CuSO4��ˮ��ͭ�ķ�Ӧԭ����Fe+CuSO4=FeSO4+Cu
D. ������̼���������̼������(x)��һ������߷�ˮ��Cu2+��ȥ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B���������Ϊ2 L���ܱ������л�ϣ�����һ�������·�����Ӧ��2A(g)��B(g)![]() xC(g)������2s����A�����ʵ���Ϊ2.8 mol��C�����ʵ���Ũ��Ϊ0.6mol/L���������м���˵������2s��������A��ʾ��ƽ����Ӧ����Ϊ0.3 mol/(L��s)����2s��������B��ʾ��ƽ����Ӧ����Ϊ0.6 mol/(L��s)����2sʱ����B��ת����Ϊ70%����x��2��������ȷ����(���� )
xC(g)������2s����A�����ʵ���Ϊ2.8 mol��C�����ʵ���Ũ��Ϊ0.6mol/L���������м���˵������2s��������A��ʾ��ƽ����Ӧ����Ϊ0.3 mol/(L��s)����2s��������B��ʾ��ƽ����Ӧ����Ϊ0.6 mol/(L��s)����2sʱ����B��ת����Ϊ70%����x��2��������ȷ����(���� )
A. �٢� B. �ڢ� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������μ��뵽��ˮ�� ��������Ӧ�����ӷ���ʽ��ȷ������ ��
A. OH��+H+ �� H2O B. H+ + NH3H2O �� NH4+ + H2O
C. HCl+OH����Cl��+H2O D. HCl+NH3H2O��Cl��+NH4++H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥþ���е��������ۣ�ѡ�õ��Լ��Ͳ��������������� ��
A. ���ᣬ���� B. ���ᣬ����
C. ����������Һ������ D. ����������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:2FeSO4��7H2O![]() Fe2O3+SO2��+SO3��+14H2O��������ͼ��ʾװ�ü���FeSO4��7H2O�����зֽ�������˵������ȷ����
Fe2O3+SO2��+SO3��+14H2O��������ͼ��ʾװ�ü���FeSO4��7H2O�����зֽ�������˵������ȷ����
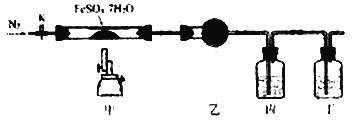
A. �ҡ��������п�����ʢװ��ˮCuSO4��Ba(NO3)2��Һ��Ʒ����Һ
B. ʵ��ʱӦ�ȴ�K������ͨ��N2���ٵ�ȼ�ƾ����
C. ���в��������ϡ�����ܽ⣬�ٵμ�KSCN����Һ���
D. ��Ӧ�ڶ�װ�ú�������ʢ��NaOH��Һ��ϴ��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ���û���Ӧ�õ�����������
A. Na��FeSO4��Һ���»�� B. COͨ�����ȵ�Fe2O3
C. H2ͨ��FeSO4��Һ D. Al��Fe3O4��ϼ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ�ij����ѧϰС�����������װ����ȡ��������֤������ijЩ���ʡ�

��ش�
��1��װ��A������a������Ϊ____________________����ȡ�����Ļ�ѧ��Ӧ����ʽΪ_____________________________________��
��2��װ��B�б���ʳ��ˮ��������_______________________________��
��3��װ��C��Ũ�����������_______________________________��
��4��ʵ�����һ��ʱ��ɹ۲쵽װ��D�еĸ������ɫ����__________________����ԭ����_____________________________��
��5��װ��E���ձ�����_______________��Һ����������_____________________���䷴Ӧ�Ļ�ѧ����ʽΪ____________________________________________________��
��6�������ɱ�״����2.24L Cl2����μӷ�Ӧ��HCl���ʵ���Ϊ____________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com