
| A、用互相滴加的方法可鉴别氯化铝溶液、氢氧化钠溶液 |
| B、向氯化铝溶液中滴加过量氨水,最终得到澄清溶液 |
| C、常温下铝与浓硝酸反应制得大量的NO2 |
| D、AlCl3溶液加热蒸干得到无水氯化铝晶体 |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应是焓变为正值 | |||
| B、增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应化学方程式为CO+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有甲烷 |
| B、一定有丙烯 |
| C、一定有乙炔 |
| D、一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉→葡萄糖→(氧化)水和二氧化碳(释放能量维持生命活动) |
| B、纤维素(水解)→葡萄糖→(氧化)水和二氧化碳(释放能量维持生命活动) |
| C、油脂→(水解)甘油和高级脂肪酸→(氧化)水和二氧化碳(释放能量维持生命活动) |
| D、蛋白质→(水解)氨基酸氨基酸→(合成)人体所需的蛋白质(人体生长发育) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.50mol/L |
| B、0.60mol/L |
| C、0.45mol/L |
| D、0.55mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
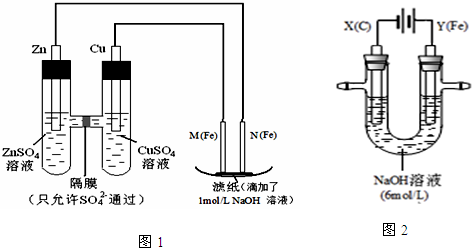
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com