
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应是焓变为负值 | |||
| B、其它条件不变,缩小容器体积,H2浓度一定增大 | |||
| C、升高温度,正反应速率增大,逆反应速率减小 | |||
D、该反应化学方程式为CO+H2O
|
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 1 mol?L-1的硫酸跟锌片反应,加入适量的硫酸钠溶液,反应速率不变 |
| B、SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 |
| C、汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
| D、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
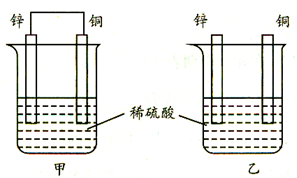 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )| A、两烧杯中铜片表面均无气泡产生 |
| B、甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极,电极反应:Zn-2e→Zn2+ |
| C、两烧杯中的pH值均增大 |
| D、产生的气泡速率甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
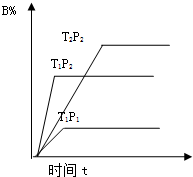 已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分
已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分| A、T1<T2 P1>P2m+n>p 正反应为吸热反应 |
| B、T1>T2 P2>P1 m+n<p 正反应为吸热反应 |
| C、T2>T1 P2>P1m+n<p 正反应为吸热反应 |
| D、T1>T2 P2>P1 m+n<p 正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2SO2(g)+O2(g)═2SO3(s)△H<-198kJ?mol-1 |
| B、增加反应物的量不能改变上述反应的△H |
| C、充分反应后,放出的热量小于198 kJ |
| D、若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com