
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol·L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol ·L-1的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
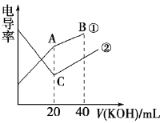
A. ①表示的是KOH溶液滴定醋酸溶液
B. A点的溶液中有c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=1.0×10-14
【答案】A
【解析】
A.溶液导电能力与离子浓度成正比,初始时HCl和醋酸浓度相同,CH3COOH只能部分电离,其导电能力较弱,则曲线①代表0.1mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,故A正确;
B.A点溶质为CH3COOK,根据CH3COOK溶液中的电荷守恒可知:c(CH3COO-)+c(OH-)-c(H+)=c(K+)=0.05mol/L,故B错误;
C.酸或碱抑制水的电离,含有弱离子的盐促进水的电离,C点溶质为KCl,不影响水的电离,A点溶质为醋酸钠,醋酸根离子水解,促进了水的电离,所以C点水电离的c(OH-)小于A点水电离的c(OH-),故C错误;
D.题中并未说明是25℃下,所以A、B、C三点溶液的Kw不一定为1.0×10-14;此外,中和反应是放热反应,A、C两点是刚好中和的点,温度高于反应前的温度,则Kw要比反应前的大,更不会是1.0×10-14;故D错误;
故选A。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g)+2O2(g) = CO2(g)+2H2O(l)= -890.3 kJ/mol
S(s)+O2(g) = SO2(g) AH=-291.2 kJ/mol
则CH4和SO2反应的热化学方程式为________。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
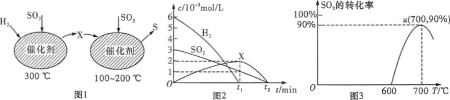
①分析可知X为_____(填化学式),0t1时间段的温度为_____.
②用H2还原SO2生成S的总反应的化学方程式为_____.
(3)焦炭催化还原SO2生成S2,化学方程式为2C(s)+2SO2(g)= S2(g)+2CO2(g)。在恒容密闭容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H____(填“ > ”或“<”)0。
②计算a点的平衡常数为_____.
(4)工业上用Na2SO3溶液处理硫酸厂的废气SO2得NaHSO3溶液。
①某温度下,用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液pH降至5时,吸收能力显著下降,应更换吸收剂。此时溶液中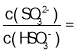 _____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50
_____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50![]() 10-2,Ka2=1.25
10-2,Ka2=1.25![]() l0-6)
l0-6)
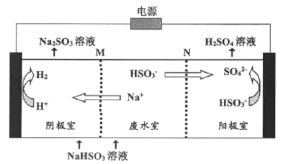
②用惰性电极电解NaHSO3废水可使吸收液再生,原理如下图所示,M和N为离子交换膜。阳极的电极反应式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、 Ba(NO3)2、NaCl、I2中的一种或几种混合而成,为检验它们做了如下实验:
a.将固体混合物溶于水后,搅拌后静置,得无色透明溶液和白色沉淀
b.过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。依实验现象判断:
(1)固体混合物中肯定有___;肯定没有___。可能有的物质是___。
(2)上述b操作中沉淀全部溶解的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
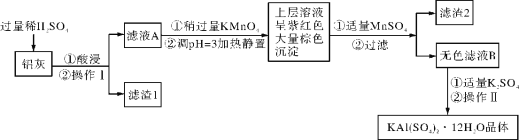
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(3)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4- 转化为Mn2+):
________________________________________。
(4)已知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:________________________。滤渣2含有的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图装置探究SO2的性质。

下列有关反应的方程式,不正确的是( )
A. ①中溶液显红色的原因: CO32-+ H2O![]() HCO3-+ OH-
HCO3-+ OH-
B. ①中溶液红色褪去的原因:2SO2 + CO32-+ H2O == CO2+ 2HSO3-
C. ②中溶液显黄绿色的原因:Cl2+ H2O == HCl + HClO
D. ②中溶液黄绿色褪去的原因:SO2+ Cl2 + 2H2O == H2SO4 + 2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中铁元素被还原的是( )
A.2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
B.Fe+CuSO4=Cu+FeSO4
C.Fe(OH)3+3HCl=FeCl3+3H2O
D.2Fe2O3+3C![]() 4Fe+3CO2↑
4Fe+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,X在周期表中原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。各物质之间的转化关系如图,部分生成物省略。

请回答下列问题:
(1)写出Z在周期表中的位置____,D的结构式____。
(2)写出A的化学式____。
(3)写出反应①的离子方程式____。
(4)为了获得氯化铜晶体,需要将B溶液在HCl氛围中蒸发结晶,原因是____。
(5)将F溶于稀硝酸,溶液变成蓝色,并放出无色气体。写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
②N2(g)+O2(g)![]() 2NO(g) ΔH2
2NO(g) ΔH2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
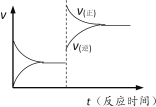
下列说法正确的是
A. 反应①使用催化剂,ΔH1减小
B. 反应②生成物总能量低于反应物总能量
C. 反应③一定能自发进行
D. 反应③达到平衡后升高温度,v(正)、v(逆)的变化如右图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氢元素可形成种类繁多的烃类物质。
(1)如图表示某些烃分子的模型:
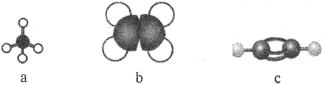
①写出a分子的空间构型:_____。
②c分子中的一个氢原子被苯基取代后的物质共直线的原子最多有____个。
③取等质量的上述三种烃充分燃烧,耗氧量最大的是___(填名称)。
④25℃和101kPa时,取a、b和c组成的混合烃32 mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了56 mL,原混合烃中c的体积分数为____。
(2)某烯烃的结构简式如图所示:![]()
①用系统命名法对该烃与H2的加成产物命名:____,该加成产物的十氯取代物有______种。
②该烯烃可以加聚生成高分子,写出该高聚物的结构简式____。该烯烃还能与乙烯以1:1比例反应形成一种环状化合物,请写出该环状化合物的键线式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com