
【题目】已知C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,X在周期表中原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。各物质之间的转化关系如图,部分生成物省略。

请回答下列问题:
(1)写出Z在周期表中的位置____,D的结构式____。
(2)写出A的化学式____。
(3)写出反应①的离子方程式____。
(4)为了获得氯化铜晶体,需要将B溶液在HCl氛围中蒸发结晶,原因是____。
(5)将F溶于稀硝酸,溶液变成蓝色,并放出无色气体。写出该反应的化学方程式____。
【答案】第2周期ⅥA族 O=C=O Cu2(OH)2CO3或CuCO3 Cu +2Fe3+= Cu2++2Fe2+ 避免Cu2+水解生成Cu(OH)2 3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O
【解析】
X在周期表中的原子半径最小,则X为H元素;G为黄绿色单质气体,则G为Cl2;反应①用于制作印刷电路板,为FeCl3和Cu反应,则L为FeCl3,K为FeCl2;E能与葡萄糖反应生成砖红色沉淀F,则F为Cu2O,E为Cu(OH)2,则B为CuCl2,M为Cu;由C+G→H+I,I有漂白作用,H能够与金属J反应生成FeCl2,则H为HCl,J为Fe,I为HClO,则C为H2O;从A+H(HCl)=B(CuCl2)+C(H2O)+D,D为无色非可燃性气体,可知,A中含有铜元素;Y、Z原子最外层电子数之和为10,Y、Z中一种为O元素,则另一种元素的原子最外层电子数为4,可能为C或Si元素,结合D为无色非可燃性气体,只能为CO2,X、Y、Z的原子序数依次增大,则Y为C元素,Z为O元素,因此A中还含有C元素,因此A为CuCO3或Cu2(OH)2CO3等,据此分析解答。
根据上述分析,X为H元素,Y为C元素,Z为O元素,A为CuCO3或Cu2(OH)2CO3等,B为CuCl2,C为H2O,D为CO2,E为Cu(OH)2,F为Cu2O,G为Cl2,H为HCl,I为HClO,J为Fe,K为FeCl2,L为FeCl3,M为Cu。
(1)Z为O元素,在周期表中位于第二周期ⅥA族;D为CO2,结构式为O=C=O,故答案为:第二周期ⅥA族;O=C=O;
(2)A 的化学式为:CuCO3或Cu2(OH)2CO3,故答案为:CuCO3或Cu2(OH)2CO3;
(3)反应①为FeCl3和Cu反应,反应的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(4)为了获得氯化铜晶体,需要将 CuCl2 溶液在 HCl 氛围中蒸发结晶,原因是:避免Cu2+水解生成Cu(OH)2,故答案为:避免Cu2+水解生成Cu(OH)2;
(5)将 Cu2O 溶于稀硝酸,溶液变成蓝色,并放出无色气体,该反应的化学方程式:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O,故答案为:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
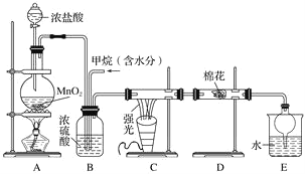
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学方程式:___________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或“不正确”)。
(2)B装置有三种功能:①控制气流速率;②混匀混合气体;③________________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1 mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为________,生成HCl的总物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂排出的废液主要含Zn(NO3)2和AgNO3,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:(已知:银可溶于硝酸;Zn(NO3)2高温下易分解,Zn(NO3)2的溶解度在溶液中受温度的影响较大)
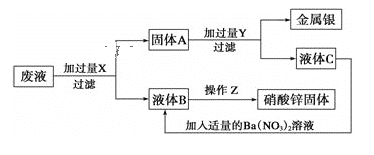
(1)X、Y分别是X:___,Y:___。(写化学式)
(2)固体A的主要成分是___。(写化学式)
(3)Z处进行的实验操作是:先过滤,将滤液___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol·L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol ·L-1的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
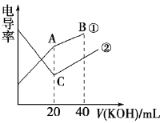
A. ①表示的是KOH溶液滴定醋酸溶液
B. A点的溶液中有c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)“水玻璃”中溶质的化学式为____,乙二醇的结构简式为____。
(2)AlCl3熔沸点较低,熔融状态不导电,则其晶体类型为____晶体。
(3)浓硝酸需避光保存在棕色试剂瓶的原因是____。(用化学方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列四个反应的方程式:
(1)铁和水蒸气的反应___________(写出化学方程式)。
(2)过氧化钠和二氧化碳的反应___________(写出化学方程式)。
(3)铝和氢氧化钠溶液的反应___________(写出离子方程式)。
(4)氧化铝与氢氧化钠反应_____________(写出离子方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求计算、整理化简并填空:
(1)若20g密度为ρgcm﹣3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是____。
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数的值用NA表示,则:
①该气体所含原子总数为___个。
②该气体在标准状况下的体积为____L。
③该气体溶于1L水中(不考虑反应),形成的溶液密度为ρg/cm3,则该溶液的物质的量浓度为____molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物总共有5种物质:O2 、H2CrO4 、Cr(OH)3 、H2O、H2O2。已知该反应中H2O2 发生如下变化过程:H2O2 → O2 ,则有:
(1)该反应中的氧化产物_________________________;
(2)配平该反应的化学方程式并用单线桥表示电子转移情况:__________________________________________。
(3)现有反应:3BrF3 + 5H2O = HBrO3 + Br2 + 9HF + O2↑,已知BrF3中F的化合价为-1价,则有该反应中的氧化剂是____________,若生成0.5 mol Br2,则反应过程中转移电子为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
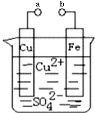
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe2+
C. a和b用导线连接时电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com