
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、 Ba(NO3)2、NaCl、I2中的一种或几种混合而成,为检验它们做了如下实验:
a.将固体混合物溶于水后,搅拌后静置,得无色透明溶液和白色沉淀
b.过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。依实验现象判断:
(1)固体混合物中肯定有___;肯定没有___。可能有的物质是___。
(2)上述b操作中沉淀全部溶解的离子方程式为:___。
【答案】Na2CO3、Ba(NO3)2 Na2SO4、I2 NaCl BaCO3+2H+=Ba2++CO2↑+H2O
【解析】
将固体混合物溶于水后,搅拌后静置,得无色透明溶液和白色沉淀,故原溶液中没有![]() ,沉淀可能为碳酸钡或硫酸钡,根据b中操作,向沉淀加硝酸沉淀完全溶解所以可以确定沉淀只有碳酸钡,据以上分析解答。
,沉淀可能为碳酸钡或硫酸钡,根据b中操作,向沉淀加硝酸沉淀完全溶解所以可以确定沉淀只有碳酸钡,据以上分析解答。
(1)将固体混合物溶于水后,搅拌后静置,得无色透明溶液和白色沉淀,故原溶液中没有![]() ,沉淀可能为碳酸钡或硫酸钡,根据b中操作,向沉淀加硝酸沉淀完全溶解所以可以确定沉淀只有碳酸钡,故原溶液中肯定含有
,沉淀可能为碳酸钡或硫酸钡,根据b中操作,向沉淀加硝酸沉淀完全溶解所以可以确定沉淀只有碳酸钡,故原溶液中肯定含有![]() ,肯定没有
,肯定没有![]() ;
;
故答案为:![]() ;
;![]() 、
、![]() ;
;
(2)沉淀溶解为碳酸钡和硝酸反应,故离子方程式为![]() ;
;
答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
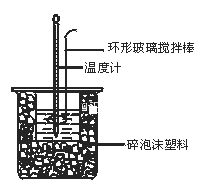
(1)图中环形搅拌棒能否用铜质用品代替______,原因是____________
(2)烧杯间填满碎纸条的作用是__________________________________
(3)每一次平行实验至少需要观察记录几次温度数值______
(4)大烧杯上如不盖硬纸板,求得的中和热数值_______________(填“偏大”“偏小”“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
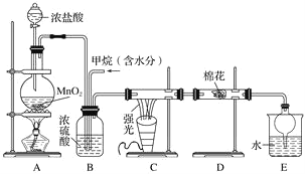
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学方程式:___________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或“不正确”)。
(2)B装置有三种功能:①控制气流速率;②混匀混合气体;③________________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1 mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为________,生成HCl的总物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积CaCl2和HCl的混合溶液中逐滴加入浓度为1 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
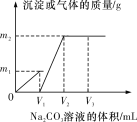
已知图中V1∶V2=1∶2;当加入V2 mL Na2CO3溶液时,所得溶液的浓度为1 mol·L-1,体积为200 mL。求:
(1)加入V2 mL Na2CO3溶液时,所得溶液的溶质是________。
(2)原混合溶液中CaCl2和HCl的物质的量之比n(CaCl2)∶n(HCl)=________。
(3)m1=________g,m2=________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列水溶液中的电离方程式或发生反应的离子方程式:
(1)小苏打溶于水___;
(2)用稀硫酸除掉镁条表面的氧化膜___;
(3)用胃舒平(有效成分是Al(OH) 3)治疗胃酸(主要成分是盐酸)过多___;
(4)用锌粉除去硫酸钾溶液中的Cd2+杂质(置换反应)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂排出的废液主要含Zn(NO3)2和AgNO3,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:(已知:银可溶于硝酸;Zn(NO3)2高温下易分解,Zn(NO3)2的溶解度在溶液中受温度的影响较大)
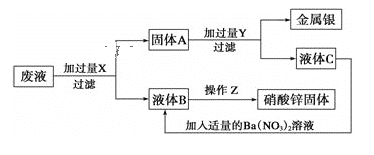
(1)X、Y分别是X:___,Y:___。(写化学式)
(2)固体A的主要成分是___。(写化学式)
(3)Z处进行的实验操作是:先过滤,将滤液___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol·L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol ·L-1的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
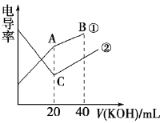
A. ①表示的是KOH溶液滴定醋酸溶液
B. A点的溶液中有c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物总共有5种物质:O2 、H2CrO4 、Cr(OH)3 、H2O、H2O2。已知该反应中H2O2 发生如下变化过程:H2O2 → O2 ,则有:
(1)该反应中的氧化产物_________________________;
(2)配平该反应的化学方程式并用单线桥表示电子转移情况:__________________________________________。
(3)现有反应:3BrF3 + 5H2O = HBrO3 + Br2 + 9HF + O2↑,已知BrF3中F的化合价为-1价,则有该反应中的氧化剂是____________,若生成0.5 mol Br2,则反应过程中转移电子为__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com