
【题目】向一定体积CaCl2和HCl的混合溶液中逐滴加入浓度为1 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
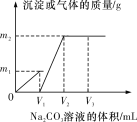
已知图中V1∶V2=1∶2;当加入V2 mL Na2CO3溶液时,所得溶液的浓度为1 mol·L-1,体积为200 mL。求:
(1)加入V2 mL Na2CO3溶液时,所得溶液的溶质是________。
(2)原混合溶液中CaCl2和HCl的物质的量之比n(CaCl2)∶n(HCl)=________。
(3)m1=________g,m2=________g。
【答案】NaCl 1∶2 2.2 5
【解析】
分析反应的过程可知:加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了,据此分析解答。
(1)加入V2 mL Na2CO3溶液时,沉淀或气体的质量不再增大,说明碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故所得溶液的溶质是NaCl;
(2) 由图像可知,向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1mol·L-1 的 Na2CO3溶液,0~V1发生的是碳酸钠与盐酸反应,生成二氧化碳的质量为m1,V1~V2发生的是碳酸钠与氯化钙的反应,生成碳酸钙的质量为m2。又知V1:V2=1:2,说明盐酸和氯化钙消耗的Na2CO3 溶液体积相等,由两个反应的化学方程式可知,n(CaCl2)∶n(HCl)= 1:2;当加入 V2mLNa2CO3 溶液时,所得溶液为氯化钠溶液,其浓度为 1 mol·L-1,体积为 200mL,所以n(NaCl)=0.2mol,由氯离子守恒可以求出n(CaCl2)=0.0500mol、n(HCl)=0.100mol,n(CaCl2)∶n(HCl)=1:2;
(3) 0~V1发生的是碳酸钠与盐酸反应,生成二氧化碳的质量为m1,则n(CO2)= ![]() n (HCl)=
n (HCl)= ![]() ×0.1mol=0.05mol,m1= n(CO2) ×M(CO2)=0.05mol×44g/mol=2.2g,由钙离子守恒可知,n(CaCO3)=n(CaCl2)=0.05mol,所以m2=0.0500mol
×0.1mol=0.05mol,m1= n(CO2) ×M(CO2)=0.05mol×44g/mol=2.2g,由钙离子守恒可知,n(CaCO3)=n(CaCl2)=0.05mol,所以m2=0.0500mol![]() 5 g。
5 g。


科目:高中化学 来源: 题型:
【题目】写出下列化学方程式或离子方程式。
(1)钠与水反应的离子方程式:___;
(2)钠与硫酸铜溶液反应的离子方程式:___;
(3)过氧化钠与二氧化碳反应的化学方程式:___;
(4)过氧化钠与二氧化硫反应的化学方程式:___;
(5)镁在氮气中点燃镁条的化学方程式:___;
(6)镁在二氧化碳中点燃镁条的化学方程式:___;
(7)铝与氢氧化钠溶液的反应的离子方程式:___;
(8)氧化铝与氢氧化钠溶液反应的离子方程式:___;
(9)氢氧化铝与氢氧化钠溶液反应的离子方程式:___;
(10)铝与四氧化三铁反应的化学方程式:___;
(11)铜与氯化铁溶液反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g)+2O2(g) = CO2(g)+2H2O(l)= -890.3 kJ/mol
S(s)+O2(g) = SO2(g) AH=-291.2 kJ/mol
则CH4和SO2反应的热化学方程式为________。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
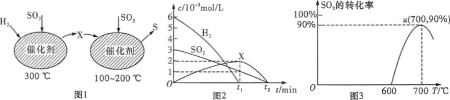
①分析可知X为_____(填化学式),0t1时间段的温度为_____.
②用H2还原SO2生成S的总反应的化学方程式为_____.
(3)焦炭催化还原SO2生成S2,化学方程式为2C(s)+2SO2(g)= S2(g)+2CO2(g)。在恒容密闭容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H____(填“ > ”或“<”)0。
②计算a点的平衡常数为_____.
(4)工业上用Na2SO3溶液处理硫酸厂的废气SO2得NaHSO3溶液。
①某温度下,用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液pH降至5时,吸收能力显著下降,应更换吸收剂。此时溶液中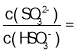 _____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50
_____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50![]() 10-2,Ka2=1.25
10-2,Ka2=1.25![]() l0-6)
l0-6)
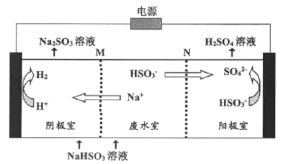
②用惰性电极电解NaHSO3废水可使吸收液再生,原理如下图所示,M和N为离子交换膜。阳极的电极反应式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,3.4 g NH3中含有的电子数为0.2NA
B.1 mol·L-1的Fe2(SO4)3溶液中,含有的SO42-数目为3NA
C.标准状况下,22.4 L CO2和O2的混合气体中含氧原子数为2NA
D.1 mol Fe在纯氧中完全燃烧,生成Fe3O4,Fe失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用下图所示A~D中的装置进行混合物的分离和提纯,按要求回答下列问题:
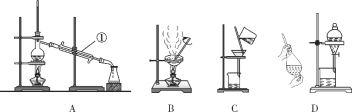
(1)仪器①的名称______________。
(2)除去Ca(OH)2溶液中悬浮的CaCO3颗粒应选用装置________(填字母代号,下同)。
(3)分离互溶的乙酸(沸点118 ℃)和乙酸乙酯(沸点77.1 ℃)的混合物应选用装置________。
(4)用CCl4提取碘水中的碘单质应选用装置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题:
(1)标准状况下,___gCO和4.48LCO2所含的分子数目相同,两种气体的碳原子数之和为___。
(2)将标况下6.72LHCl气体溶于水,配成100mL溶液,得到物质的量浓度为___的盐酸溶液。
(3)已知8gA与32gB恰好完全反应,只生成0.5molC和18gD,则C的摩尔质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、 Ba(NO3)2、NaCl、I2中的一种或几种混合而成,为检验它们做了如下实验:
a.将固体混合物溶于水后,搅拌后静置,得无色透明溶液和白色沉淀
b.过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。依实验现象判断:
(1)固体混合物中肯定有___;肯定没有___。可能有的物质是___。
(2)上述b操作中沉淀全部溶解的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
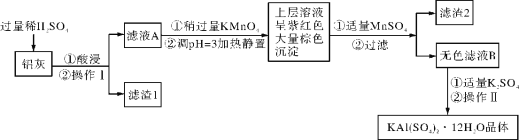
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(3)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4- 转化为Mn2+):
________________________________________。
(4)已知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:________________________。滤渣2含有的物质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
②N2(g)+O2(g)![]() 2NO(g) ΔH2
2NO(g) ΔH2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
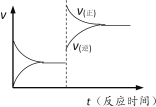
下列说法正确的是
A. 反应①使用催化剂,ΔH1减小
B. 反应②生成物总能量低于反应物总能量
C. 反应③一定能自发进行
D. 反应③达到平衡后升高温度,v(正)、v(逆)的变化如右图所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com