
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
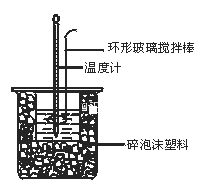
(1)图中环形搅拌棒能否用铜质用品代替______,原因是____________
(2)烧杯间填满碎纸条的作用是__________________________________
(3)每一次平行实验至少需要观察记录几次温度数值______
(4)大烧杯上如不盖硬纸板,求得的中和热数值_______________(填“偏大”“偏小”“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”“不相等”)。
【答案】不能 铜导热,热量损失较大 减少实验过程中的热量损失 3次 偏小 相等
【解析】
(1)根据金属棒是热的良导体,易传热;
(2)中和热测定实验成败的关键是保温工作;
(3)根据温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度;
(4)不盖硬纸板,会有一部分热量散失;
(5)根据中和热的概念和实质来回答。
(1)铜质搅拌棒的导热性好,易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低,故答案为:不能;铜导热,热量损失较大;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,求出两者的平均值,混合反应后测最高温度,最后求出温度差,一共记录3次温度数,故答案为:3次;
(4)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(5)中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50molL-1盐酸跟50mL 0.55molL-1NaOH溶液进行反应,与上述实验相比,所求中和热相等;故答案为:相等。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3 (g) +5O2(g)![]() 4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
A. 2分钟反应放出的热.量值小于0.1akJ
B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ·L-1 ·min-1
C. 2分钟内NH3的转化率是50%
D. 2分钟末 c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学方程式或离子方程式。
(1)钠与水反应的离子方程式:___;
(2)钠与硫酸铜溶液反应的离子方程式:___;
(3)过氧化钠与二氧化碳反应的化学方程式:___;
(4)过氧化钠与二氧化硫反应的化学方程式:___;
(5)镁在氮气中点燃镁条的化学方程式:___;
(6)镁在二氧化碳中点燃镁条的化学方程式:___;
(7)铝与氢氧化钠溶液的反应的离子方程式:___;
(8)氧化铝与氢氧化钠溶液反应的离子方程式:___;
(9)氢氧化铝与氢氧化钠溶液反应的离子方程式:___;
(10)铝与四氧化三铁反应的化学方程式:___;
(11)铜与氯化铁溶液反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:
(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为__。(保留小数点后一位)
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是___。(多选)
A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种治疗济疮的新型药物,合成路线如下:
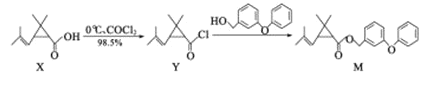
下列说法不正确的是
A.X的分子式为C11H16O2
B.Y分子中所有碳原子不可能在同一平面上
C.Y生成M的反应类型为取代反应
D.可用NaHCO3溶液或溴水鉴别X和M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氮原子的氮气在标准状况下的体积约为22.4L
B.标准状况下,11.2L![]() 含有的分子数为0.5NA
含有的分子数为0.5NA
C.在常温常压下,11.2 L![]() 含有的分子数为0.5NA
含有的分子数为0.5NA
D.![]() 和
和![]() 的混合物,所含氧原子数为0.2NA
的混合物,所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g)+2O2(g) = CO2(g)+2H2O(l)= -890.3 kJ/mol
S(s)+O2(g) = SO2(g) AH=-291.2 kJ/mol
则CH4和SO2反应的热化学方程式为________。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
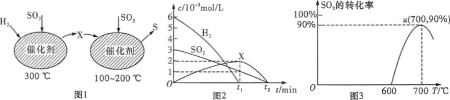
①分析可知X为_____(填化学式),0t1时间段的温度为_____.
②用H2还原SO2生成S的总反应的化学方程式为_____.
(3)焦炭催化还原SO2生成S2,化学方程式为2C(s)+2SO2(g)= S2(g)+2CO2(g)。在恒容密闭容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H____(填“ > ”或“<”)0。
②计算a点的平衡常数为_____.
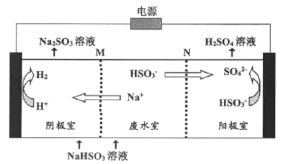
(4)工业上用Na2SO3溶液处理硫酸厂的废气SO2得NaHSO3溶液。
①某温度下,用1.0mol/LNa2SO3溶液吸收纯净的SO2,当溶液pH降至5时,吸收能力显著下降,应更换吸收剂。此时溶液中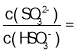 _____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50
_____。(已知该温度下H2SO3的电离平衡常数:Ka1=1.50![]() 10-2,Ka2=1.25
10-2,Ka2=1.25![]() l0-6)
l0-6)
②用惰性电极电解NaHSO3废水可使吸收液再生,原理如下图所示,M和N为离子交换膜。阳极的电极反应式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、 Ba(NO3)2、NaCl、I2中的一种或几种混合而成,为检验它们做了如下实验:
a.将固体混合物溶于水后,搅拌后静置,得无色透明溶液和白色沉淀
b.过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。依实验现象判断:
(1)固体混合物中肯定有___;肯定没有___。可能有的物质是___。
(2)上述b操作中沉淀全部溶解的离子方程式为:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com