
【题目】下列化学用语正确的是( )
A.CCl4的电子式:
B.乙烷分子的分子式:CH3CH3
C.苯分子的最简式为:C6H6
D.丙烷的球棍模型:![]()
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g);△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
2SO3(g);△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
A.达到反应限度时,生成SO3为2mol
B.达到反应限度时,反应放出的热量一定小于197kJ
C.达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D.达到反应限度时SO2的消耗速率必定等于SO3的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Ba(OH)2·8H2O固体与NH4Cl固体反应的化学方程式为_____________。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3___________热量(填“吸收”或“放出”)__________kJ;事实上,反应的热量总小于理论值,为什么?________________。
(3)一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)

(4)已知N2(g)+ 3H2(g) ![]() 2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
(5)已知一定条件下发生:2SO2(g) + O2(g) ![]() 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)

t1________________________;t2________________________;
t3________________________;t4________________________。
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中_______作正极,负极的电极反应为_________________。
②甲烷燃料电池示意图如上图乙,其负极反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活、生产息息相关,下列说法正确的是
A.氯水和食盐水消毒杀菌的原理相同
B.制造普通玻璃的原料为石英砂、石灰石和纯碱
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.可以用钢瓶储存液氯和浓H2SO4,因为它们对钢瓶发生了钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是
A.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
B.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2分子存在
C.加入盐酸酸化,再加入硝酸银溶液,产生白色沉淀,说明氯水中有Cl﹣存在
D.氯水放置数天后酸性将减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1 molL﹣1.某同学进行了如下实验:下列说法正确的是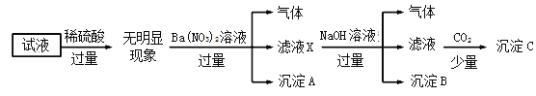
A.无法确定原试液中是否含有SO42﹣
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.沉淀C为Al(OH)3
D.原试液中一定不含有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、b均能与稀硫酸反应放出气体;②c与d的硝酸盐溶液反应,置换出单质d;③b与强碱反应放出气体;④b、e在冷的浓硫酸中钝化。由此可判断a、b、c、d、e依次是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com