
【题目】将某些化学知识用数轴表示,可以收到直观、简明、易记的效果.用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系:
B.分散系的分类:
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
D.CO2与NaOH溶液反应后的产物![]()
【答案】C
【解析】解:A.S的化合价为﹣2时,化合价最低,只能做还原剂,时S的化合价为+6,化合价最高,只能做氧化剂,在中间价态时既能做氧化剂,又能做还原剂,故A错误; B.分散系的根本区别在于分散质微粒直径的大小,小于100nm为溶液,大于100nm为浊液,在1nm~100nm的为胶体,故B错误;
C.Al3++3OH﹣=Al(OH)3↓,Al3++4OH﹣=AlO2﹣+2H2O, ![]() <3,铝元素以Al3+和Al(OH)3形式存在;
<3,铝元素以Al3+和Al(OH)3形式存在; ![]() =3,则以Al(OH)3形式存在;3<
=3,则以Al(OH)3形式存在;3< ![]() <4以 AlO2﹣和Al(OH)3形式存在;
<4以 AlO2﹣和Al(OH)3形式存在; ![]() ≥4只以 AlO2﹣形式存在,故C正确;
≥4只以 AlO2﹣形式存在,故C正确;
D.2NaOH+CO2(少量)═Na2CO3+H2O,NaOH+CO2(足)═NaHCO3 , ![]() ≤1,生成NaHCO3;1<
≤1,生成NaHCO3;1< ![]() <2,产物为NaHCO3与Na2CO3 , 混合物;
<2,产物为NaHCO3与Na2CO3 , 混合物; ![]() ≥2,只生成Na2CO3 , 故D错误.
≥2,只生成Na2CO3 , 故D错误.
故选C.
A.根据元素的化合价判断物质的氧化性和还原性;
B.分散系的根本区别在于分散质微粒直径的大小,小于100nm为溶液,大于100nm为浊液,在1nm~100nm的为胶体;
C.根据可能发生的反应Al3++3OH﹣=Al(OH)3↓,Al3++4OH﹣=AlO2﹣+2H2O分析;
D.根据可能发生的反应2NaOH+CO2(少量)═Na2CO3+H2O,NaOH+CO2(足)═NaHCO3分析.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】如右图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C,D相连通.其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2N2O4△H=﹣57kJ/mol;当向A中加入50g NH4NO3晶体使之溶解;向B中加入2g苛性钠时: 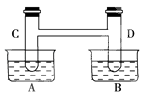
(1)C中的气体颜色;D中的气体颜色 .
(2)25℃时,2NO2N2O4达到平衡时,c(NO2)=0.012 5mol/L,c(N2O4)=0.032 1mol/L,则NO2的起始浓度为 , NO2的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性FeSO3溶液中含有少量的SnSO4 , 为得到纯净的硫酸亚铁晶体(FeSO4xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
25℃ | pH | 25℃ | pH |
饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(1)用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是 .
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+ , 可选用的试剂为 .
A.KSCN溶液
B.稀硫酸
C.淀粉﹣KI溶液
D.KMnO4溶液
(3)通入H2S气体至饱和的目的是;用硫酸酸化至pH=2的目的是 .
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有 .
②实验中要持续通入氮气,否则测出的x会(填“偏于”、“偏于”或“不变”).
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液.
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感染禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.
(1)金刚乙烷可通过下列转化生成金刚乙胺:
①金刚乙烷的分子式为 .
②反应Ⅰ的反应类型为 . 反应Ⅱ的另一产物为 .
(2)金刚乙烷还可通过如图下列转化生成高分子化合物(用“R﹣”表示  ,如金刚乙烷表示为R﹣CH2CH3);
,如金刚乙烷表示为R﹣CH2CH3); ![]()
已知:E分子中有两个C=O双键,但不能发生银镜反应;标准状况下,1molF与足量的钠完全反应会生成22.4L气体,若与足量NaHCO3溶液完全反应也会生成22.4L气体.
①条件1为 .
②条件2为 , 写出C→D的化学方程式: .
③E分子中官能团的名称为 , G的结构简式为 .
④满足下列条件的F的同分异构体只有一种,其结构简式为 .
a.属于芳香族化合物
b.核磁共振氢谱图中只有两组吸收峰,且峰面积之比为1:1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,离子方程式书写正确的是( )
A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO ![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
B.泡沫灭火器的灭火原理:2Al3++3CO ![]() +3H2O=2Al(OH)3↓+3CO2↑
+3H2O=2Al(OH)3↓+3CO2↑
C.向硝酸银溶液中加入足量的氨水:Ag++2NH3?H2O=Ag(NH3)2++2H2O
D.用足量的氨水处理硫酸工业的尾气:SO2+NH3?H2O=NH ![]() +HSO
+HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验,验证元素周期律.
(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞试液,依次加入大小相近的锂、钠、钾块,观察现象.①甲同学设计实验的目的是;
②反应最剧烈的烧杯是(填字母);
③写出b烧杯里发生反应的离子方程式 .
(2)乙同学设计实验验证:元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如下图装置验证C、N、Si三种元素的非金属性强弱.
①写出所选用物质的化学式:A; B;C;
②写出圆底烧瓶中发生反应的离子方程式;
③写出烧杯中发生反应的离子方程式;
④碳、氮、硅三种元素的非金属性由强到弱顺序为;
(3)丙同学认为乙同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该置中应盛放(填试剂).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求填空:
(1)Mg2+的结构示意图为;O的电子式为;H2S的结构式为 .
(2)氯化钠的电子式为 , 溶于水发生电离的电离方程式为 , 向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.氨气具有还原性,可用作制冷剂
B.次氯酸具有弱酸性,可用作有色物质的漂白剂
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.碳酸钠溶液显碱性,可用其热溶液除去金属餐具表面油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇结构如右式,它广泛存在于食物(例如 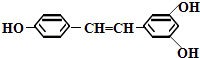 桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够与1mol该化合物起反应的Br2或H2的最大用量分别是( )
桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够与1mol该化合物起反应的Br2或H2的最大用量分别是( )
A.6mol,7mol
B.5mol,7mol
C.3.5mol,6mol
D.1mol,1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com