
【题目】某酸性FeSO3溶液中含有少量的SnSO4 , 为得到纯净的硫酸亚铁晶体(FeSO4xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
25℃ | pH | 25℃ | pH |
饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(1)用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是 .
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+ , 可选用的试剂为 .
A.KSCN溶液
B.稀硫酸
C.淀粉﹣KI溶液
D.KMnO4溶液
(3)通入H2S气体至饱和的目的是;用硫酸酸化至pH=2的目的是 .
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有 .
②实验中要持续通入氮气,否则测出的x会(填“偏于”、“偏于”或“不变”).
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液.
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为 .
【答案】
(1)铁粉和稀硫酸
(2)AC
(3)除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀
(4)二氧化硫;偏小;7
【解析】解:(1)用硫酸亚铁晶体配置FeSO4溶液时要抑制亚铁离子水解和被氧气氧化,所以用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是少量铁粉和稀硫酸,所以答案是:铁粉和稀硫酸;(2)KSCN溶液与Fe3+的溶液反应会使溶液呈血红色,Fe3+有氧化性,能将碘离子氧化成碘单质,碘遇淀粉显蓝色,所以检验硫酸亚铁晶体中是否含有Fe3+ , 可以用KSCN溶液或淀粉﹣KI溶液,
故选AC;(3)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
所以答案是:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;(4)①二氧化硫能使高锰酸钾溶液褪色,
所以答案是:二氧化硫;
②实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,
所以答案是:偏小;
④通过FeSO4xH2O的化学式可知铁原子和水的个数比为1:x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
所以答案是:7.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有关麦芽糖的下列叙述中,错误的是( )
A.纯净的麦芽糖是无色晶体,易溶于水,有甜味
B.麦芽糖能发生银镜反应,是一种还原性糖
C.1 mol麦芽糖水解得到1 mol葡萄糖和1 mol果糖
D.麦芽糖和蔗糖互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( ) 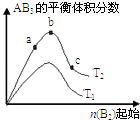
A.正反应一定是放热反应
B.若T2>T1 , 则正反应一定是吸热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.b点时,平衡体系中A,B原子数之比接近3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌粒与过量稀硫酸反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是( )
A. 升高温度B. 滴加少量浓硫酸
C. 滴加少量浓硝酸溶液D. 改用等质量的锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,X,Y,W,Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( ) ![]()
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<X
D.W,Z的氧化物都能与碱反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:
(1)粉煤灰研磨的目的是 .
(2)第1次过滤时滤渣的主要成分有(填化学式,下同)和 , 第3次过滤时滤渣的成分是
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为h;铝的浸取率与 ![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 ![]() 相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例).
相同时,浸取率最高的是(填化学式);用含氟的化合物作这种助溶剂的缺点是(举一例). 
(4)流程中循环使用的物质有和 . (填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C136H20,该过程能够发生的原因是
(6)用粉煤灰制取含铝化合物的主要意义是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成是一项重要的化工生产.已知合成氨有关能量变化的图象如图1.
(1)反应N2(g)+3H2(g) ![]() 2NH3(g)△H=KJ/mol;
2NH3(g)△H=KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | X | 946 |
则表中X的值是 .
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某些化学知识用数轴表示,可以收到直观、简明、易记的效果.用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系:
B.分散系的分类:
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
D.CO2与NaOH溶液反应后的产物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:
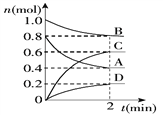
(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com