
【题目】氨的合成是一项重要的化工生产.已知合成氨有关能量变化的图象如图1.
(1)反应N2(g)+3H2(g) ![]() 2NH3(g)△H=KJ/mol;
2NH3(g)△H=KJ/mol;
(2)已知键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | X | 946 |
则表中X的值是 .
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 .
科目:高中化学 来源: 题型:
【题目】关于如图装置的叙述,正确的是( ) 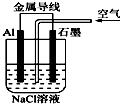
A.铝是负极,铝片上析出无色气体
B.溶液中两电极间产生白色沉淀
C.溶液中先产生白色沉淀,最后沉淀溶解
D.石墨是正极,石墨棒上析出黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2与Cl2的氧化性质相近,在自来水消毒和果蔬保鲜等方面应用广泛.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是 .
(2)ClO2是第四代高效、无毒的广谱消毒剂.它可由NaClO2溶液与NCl3溶液反应制得,其反应的离子方程式为NCl3+6ClO ![]() +3H2O═6ClO2+3Cl﹣+3OH﹣+Y,则Y的化学式是 .
+3H2O═6ClO2+3Cl﹣+3OH﹣+Y,则Y的化学式是 .
(3)NaClO2在酸性条件下可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式是 .
(4)已吸收ClO2的稳定性Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示,若将其用于水果保鲜,你认为效果较好的稳定剂是 , 其原因是 . 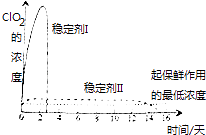
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性FeSO3溶液中含有少量的SnSO4 , 为得到纯净的硫酸亚铁晶体(FeSO4xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
25℃ | pH | 25℃ | pH |
饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(1)用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是 .
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+ , 可选用的试剂为 .
A.KSCN溶液
B.稀硫酸
C.淀粉﹣KI溶液
D.KMnO4溶液
(3)通入H2S气体至饱和的目的是;用硫酸酸化至pH=2的目的是 .
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有 .
②实验中要持续通入氮气,否则测出的x会(填“偏于”、“偏于”或“不变”).
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液.
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Fe+3Cl2 ![]() 2FeCl3 , 当28gFe在71gCl2中点燃时( )
2FeCl3 , 当28gFe在71gCl2中点燃时( )
A.Fe和Cl2恰好完全反应
B.生成99gFeCl3
C.会有9.33gFe过量
D.会有17.75gCl2过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感染禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.
(1)金刚乙烷可通过下列转化生成金刚乙胺:
①金刚乙烷的分子式为 .
②反应Ⅰ的反应类型为 . 反应Ⅱ的另一产物为 .
(2)金刚乙烷还可通过如图下列转化生成高分子化合物(用“R﹣”表示  ,如金刚乙烷表示为R﹣CH2CH3);
,如金刚乙烷表示为R﹣CH2CH3); ![]()
已知:E分子中有两个C=O双键,但不能发生银镜反应;标准状况下,1molF与足量的钠完全反应会生成22.4L气体,若与足量NaHCO3溶液完全反应也会生成22.4L气体.
①条件1为 .
②条件2为 , 写出C→D的化学方程式: .
③E分子中官能团的名称为 , G的结构简式为 .
④满足下列条件的F的同分异构体只有一种,其结构简式为 .
a.属于芳香族化合物
b.核磁共振氢谱图中只有两组吸收峰,且峰面积之比为1:1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,离子方程式书写正确的是( )
A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO ![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
B.泡沫灭火器的灭火原理:2Al3++3CO ![]() +3H2O=2Al(OH)3↓+3CO2↑
+3H2O=2Al(OH)3↓+3CO2↑
C.向硝酸银溶液中加入足量的氨水:Ag++2NH3?H2O=Ag(NH3)2++2H2O
D.用足量的氨水处理硫酸工业的尾气:SO2+NH3?H2O=NH ![]() +HSO
+HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求填空:
(1)Mg2+的结构示意图为;O的电子式为;H2S的结构式为 .
(2)氯化钠的电子式为 , 溶于水发生电离的电离方程式为 , 向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 17gOH-中含有的电子数为NA
B. 6.5gZn与足量盐酸反应失去的电子数为0.2NA
C. 1L1mol/LCaC12溶液中含有的Cl-离子数目为NA
D. 常温常压下,11.2LO2中含有的原子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com