
【题目】某溶液中可能含有K+、Fe2+、Ca2+、![]() 、
、![]() 、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
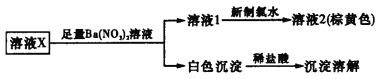
A.取溶液2,加入AgNO3溶液,可确定溶液X中是否含有Cl-
B.溶液X中一定不含Fe2+、Ca2+、![]()
C.溶液X中是否存在K+还需要通过焰色反应进一步确认
D.溶液X的溶质为K2CO3和KI
【答案】B
【解析】
溶液X加入足量的硝酸钡溶液生成白色沉淀和溶液1,再加入新制氯水得棕黄色溶液2,则说明含有I2,则原溶液中含有I-;白色沉淀加入稀盐酸全部溶解,则X中应含有![]() ,不含Ca2+、
,不含Ca2+、![]() 、Fe2+,由溶液的电中性可知阳离子为K+,不能确定是否含有Cl-,以此解答该题。
、Fe2+,由溶液的电中性可知阳离子为K+,不能确定是否含有Cl-,以此解答该题。
A.溶液X加入足量的硝酸钡溶液生成白色沉淀和溶液1,再加入新制氯水得溶液2,所以取溶液2,加入AgNO3溶液,不能确定溶液X中是否含有Cl-,故A错误;
B.由上述分析可知,溶液X中一定不含Fe2+、Ca2+、![]() ,故B正确;
,故B正确;
C.根据溶液的电中性可知,一定有阳离子为K+存在,故C错误;
D.根据溶液中一定存在的离子K+、![]() 、I-,可能存在Cl-,可知溶液X的溶质可能为K2CO3和KI,可能有KC1,故D错误;
、I-,可能存在Cl-,可知溶液X的溶质可能为K2CO3和KI,可能有KC1,故D错误;
故选B。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】某工业废渣的主要成分为 SiO2、FeO、MgO,对其进行处理以回收废渣中的金属元素。25℃时,金属离子的物质的量浓度的负对数(-lg c)与溶液pH的关系如图所示(一般离子浓度 c≤10-5mol/L时,即认为该离子在溶液中不存在)。下列有关说法不正确的是
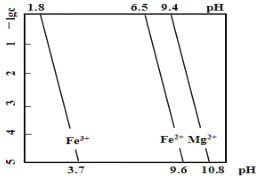
A.分离废渣中的SiO2,可以用过量的盐酸充分反应后过滤
B.可以用氯水将Fe2+氧化成Fe3+以便于铁元素与镁元素的分离
C.沉淀金属元素的顺序是先沉淀镁元素再沉淀铁元素
D.用 NaOH 调节pH沉淀铁元素时,pH应控制略大于3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
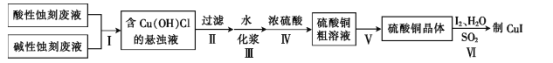
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
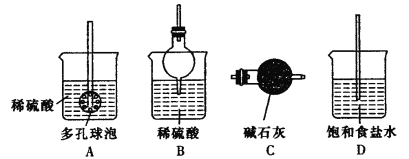
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
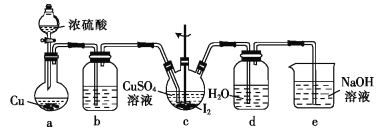
①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是

A.增大压强既可以加快反应速率,又可以提高原料转化率
B.升高温度可提高平衡转化率
C.冷却过程中采用热交换有助于节约能源
D.原料循环可提高其利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+Br2(g)![]() 2HBr(g)分下列三步进行,有关键能如下表所示:
2HBr(g)分下列三步进行,有关键能如下表所示:

①Br2![]() 2Br(快反应) △H1,K1
2Br(快反应) △H1,K1
②Br+H2![]() HBr+H(慢反应) △H2,K2
HBr+H(慢反应) △H2,K2
③H+Br![]() HBr(快反应) △H3,K3
HBr(快反应) △H3,K3
则下列说法错误的是
A.△H1>△H2>△H3
B.25℃时:K1>K3
C.H2(g)+Br2(g)![]() 2HBr(g)的速率由反应②的速率决定
2HBr(g)的速率由反应②的速率决定
D.H2(g)+Br2(g)![]() 2HBr(g) △H<0
2HBr(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3),其流程如图1所示,硫酸镁和硼酸的溶解度随温度的变化曲线如图2所示。
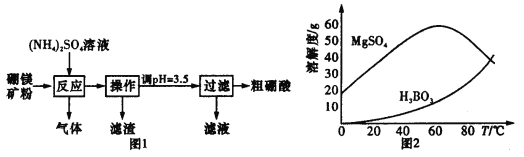
请回答下列问题:
(1)流程中“反应”的实验装置如下图所示:
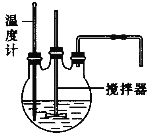
①反应时需控制在95℃进行,控制反应温度的适宜方法是____________________。
②反应产生的气体需要净化处理,请从下图中选择合适的装置__________(填字母代号)。
(2)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是______________________。
(3)实验时若被强碱溅到,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____________。
(4)滴定硼酸时不能直接滴定,因为硼酸是很弱的酸,Ka=5.7×10-10。滴定前,须先将硼酸与甘油作用生成甘油硼酸,Ka=8.4×10-6,然后用酚酞作指示剂,再用NaOH标准溶液滴定。已知硼酸的摩尔质量为61.8 g·mol-1,滴定前称取3.00 g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.200 0 mol·L-1 NaOH标准液的平均体积为20.00 mL。
①计算所得硼酸的纯度=__________。
②若用NaOH标准溶液直接滴定硼酸,则硼酸的纯度将__________(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有: K+、 Na+、Clˉ、CO32ˉ、SO42ˉ等离子,将该固体溶解所得到的溶液进行如下实验:

下列说法正确的是
A. 该混合物一定是K2CO3和 NaCl B. 该混合物可能是 Na2CO3和 KCl
C. 该混合物一定是Na2CO3和 NaCl D. 该混合物可能是 Na2SO4和 Na2CO3
【答案】B
【解析】焰色反应呈黄色,说明一定含有Na+;加入过量硝酸钡生成能溶于盐酸的沉淀,原溶液一定含有CO32ˉ,一定不含SO42ˉ;加入过量硝酸钡后的滤液中加入硝酸酸化的硝酸银,生成白色沉淀,则原溶液一定含有Clˉ;根据以上分析,一定含有Na+、Clˉ、CO32ˉ,一定不含SO42ˉ,可能含有K+;所以该混合物可能是 Na2CO3、 KCl或K2CO3、NaCl,故B正确。
【题型】单选题
【结束】
20
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com