
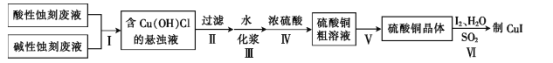
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
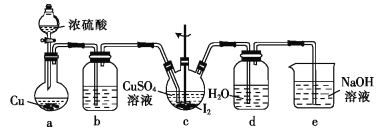
①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
【答案】Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+ 热水浴 冷却结晶 过滤(洗涤) 分液漏斗 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 三颈烧瓶中无紫色固体,只有白色固体 可防止CuI被空气中的O2氧化 使固体快速干燥并溶解表面可能混有的I2
CuSO4+SO2↑+2H2O 三颈烧瓶中无紫色固体,只有白色固体 可防止CuI被空气中的O2氧化 使固体快速干燥并溶解表面可能混有的I2
【解析】
由流程图可知,酸性蚀刻废液和碱性蚀刻废液混合反应得到Cu(OH)Cl悬浊液,过滤,将Cu(OH)Cl加水、过浆后,与浓硫酸水浴加热反应生成硫酸铜,硫酸铜粗溶液经蒸发浓缩、冷却结晶、过滤、干燥、洗涤得到硫酸铜晶体,硫酸铜晶体与碘、二氧化硫和水反应生成碘化亚铜白色固体。
(1)步骤Ⅰ中Cu(NH3)42+与盐酸反应生成Cu(OH)Cl沉淀和氯化铵,反应的离子方程式Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+,故答案为:Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+;
(2)步骤Ⅳ为Cu(OH)Cl加水、过浆后,与浓硫酸在控制pH为1~2,80 ℃下水浴加热反应反应生成硫酸铜,故答案为:热水浴;
(3)步骤Ⅴ为硫酸铜粗溶液经蒸发浓缩、冷却结晶、过滤、干燥、洗涤得到硫酸铜晶体,故答案为:冷却结晶;过滤;洗涤;
(4)①装置a中盛装浓硫酸的仪器为分液漏斗;圆底烧瓶中铜与浓硫酸共热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:分液漏斗;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:分液漏斗;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②当硫酸铜晶体与碘、二氧化硫和水反应完全生成碘化亚铜白色固体时,三颈烧瓶中无紫色固体,只有白色固体,故答案为:三颈烧瓶中无紫色固体,只有白色固体;
③装置d中的溶液为二氧化硫的饱和水溶液,碘化亚铜具有还原性,易被空气中的氧气氧化,用二氧化硫水的饱和水溶液洗涤碘化亚铜,可以防止碘化亚铜被空气中的氧气氧化;再用无水乙醇洗涤可以溶解除去碘化亚铜表面可能混有的单质碘,并能使固体快速干燥,故答案为:可防止CuI被空气中的O2氧化;使固体快速干燥并溶解表面可能混有的I2。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】浅绿色盐X仅含四种元素,不含结晶水,M(X)<908gmol-1,某小组为了探究X的组成和性质,设计并完成了如下实验

上述实验中,得到23.3g白色沉淀 E、28.8g红色固体G和12.8g红色固体H。
已知:①X分解成A、B、C的反应为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式_______________;X的化学式是__________。
(2)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为:__________。
(3)请写出G溶于D溶液的离子方程式:_________________。
(4)请设计实验检验固体C中是否仍含有X:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水基二次电池原理如下式,电解液为含Zn2+的水溶液,该电池可用于电网贮能。xZn+Zn0.25V2O5﹒yH2O![]() Zn0.25V2O5﹒zH2O+(y-z)H2O。下列说法正确的是
Zn0.25V2O5﹒zH2O+(y-z)H2O。下列说法正确的是
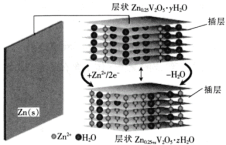
A.放电时,Zn2+脱离插层
B.放电时,溶液中Zn2+浓度一直减小
C.充电时,电子由![]() 层经电解质溶液流向
层经电解质溶液流向![]() 层
层
D.充电时,阳极反应为:Zn0.25V2O5﹒zH2O+(y-z)H2O-2xe-= Zn0.25V2O5﹒yH2O+xZn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
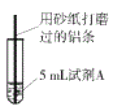
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
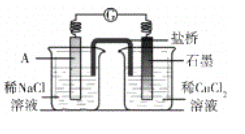
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是
A.较浓盐酸可有效抑制Fe3+水解
B.稀释过程中FeCl3水解程度增大,c(H+)增大
C.FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+
D.FeCl3溶液显黄色,没有Fe(OH)3存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
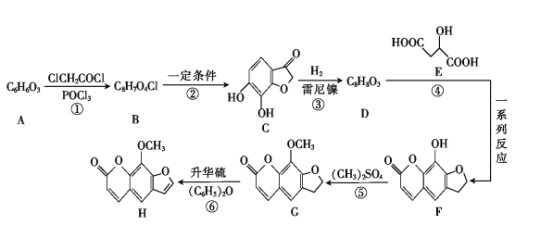
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Fe2+、Ca2+、![]() 、
、![]() 、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
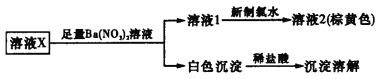
A.取溶液2,加入AgNO3溶液,可确定溶液X中是否含有Cl-
B.溶液X中一定不含Fe2+、Ca2+、![]()
C.溶液X中是否存在K+还需要通过焰色反应进一步确认
D.溶液X的溶质为K2CO3和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
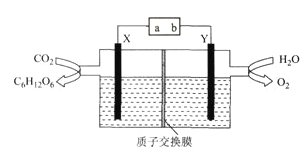
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com