
【题目】工业排放的烟气中的SO2是大气的一次污染物之一,同时也是雾篮天气的重要前体物。工业上常用氨水吸二氧化硫气体。常温时,向10mL0.1molL-l的氨水中通入SO2,SO2体积(标准状况)与溶液pH的关系如图所示(忽略溶液体积变化)。
已知:25℃时,NH3H2O的Kb=l.7×l0-5,H2SO3的Ka1=l.3×10-2,Ka2=6.2×l0-8。
回答下列问题:
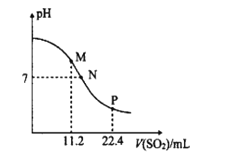
(1)M点溶液中阴离子浓度由大到小的顺序为__,![]() __(填>、=或<)2。
__(填>、=或<)2。
(2)N点溶液中的溶质为__(填化学式),c(NH4+):c(HSO3-)=__。
(3)水的电离程度M点__P点(填“大于”、“小于”或“等于”)。
(4)反应NH3H2O+H2SO3![]() NH4++HSO3-+H2O的平衡常数K=__。
NH4++HSO3-+H2O的平衡常数K=__。
【答案】c(OH-)>c(HSO3-)>c(SO32-) > NH4HSO3和NH3H2O 2.24 < 2.21×107
【解析】
(1)M点n(SO2)=![]() mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-);
mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-);
(2)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,P点n(SO2)=![]() mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),
mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),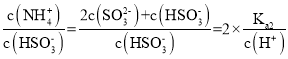 +1;
+1;
(3)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,抑制水电离,P点溶质为NH4HSO3,抑制水电离;
(4)反应NH3H2O+H2SO3NH4++HSO3-+H2O的平衡常数K=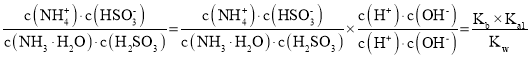 。
。
(1)M点n(SO2)=![]() mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-),所以
mol=5×l0-4mol/L,n(NH3H2O)=0.1mol/L×0.01L=l0-3mol/L,则混合溶液中溶质为等物质的量浓度的NH4HSO3和NH3H2O,溶液pH>7,溶液呈碱性,c(OH-)>c(H+),说明NH3H2O电离程度大于HSO3-电离程度,HSO3-电离程度较小;溶液呈碱性,c(OH-)>c(H+),溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(NH4+)>2c(SO32-)+c(HSO3-),所以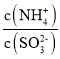 >2;
>2;
(2)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,P点n(SO2)=![]() mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,N点介于M、P点之间,则N点溶质为NH4HSO3和NH3H2O;溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),
mol=l0-3mol/L=n(NH3H2O),溶质为NH4HSO3,N点介于M、P点之间,则N点溶质为NH4HSO3和NH3H2O;溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=2c(SO32-)+c(HSO3-),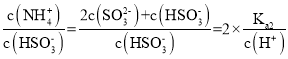 +1=2×
+1=2×![]() =2.24;
=2.24;
(3)M点溶质为等物质的量浓度的NH4HSO3和NH3H2O,抑制水电离,P点溶质为NH4HSO3,抑制水电离,抑制水电离程度:M>P,所以水电离程度:M<P;
(4)反应NH3H2O+H2SO3NH4++HSO3-+H2O的平衡常数K=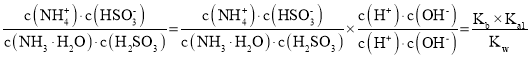 =
=![]() =2.21×107。
=2.21×107。


科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。试回答:
(1)烃A的分子式为______________。
(2)若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有______g烃A参加了反应,燃烧时消耗氧气______摩尔。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为______________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物分子中含有4个甲基,烃A可能有的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研工作者研发了电解熔融甲硫醇钠(CH3SNa)制备杀虫剂CH3-S-S-CH3的方法,克服了常规合成法造成的污染,并大幅度提高了原料转化率。基本原理如图所示,A、B为惰性电极,CH3-S-S-CH3在A电极产生,下列说法错误的是( )
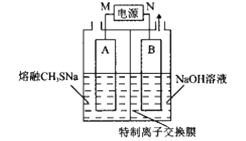
A.M极为电源的正极,B极为电解池的阴极
B.A极的电极反应:2CH3S-+2e-═CH3-S-S-CH3
C.装置中的离子交换膜为阳离子交换膜
D.该装置工作一段时间,右侧电极室中NaOH浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用,其中铁和铜是两种应用广泛的元素。
(1)基态铁原子的价电子轨道表达式为_____。
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是_____,1mol 尿素分子中含有的 σ 键数目为_____。 CH3COONa 中碳原子的杂化类型为_________。
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是_____,写出与CO互为等电子体的分子的电子式_____(任写一种)。
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因_____。
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:
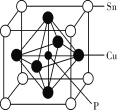
①其化学式为_____。
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为_____pm(用含 NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物的用途广泛。 下图表示两个常见固氮反应的平衡常数的对数值(lgK)与温度的关系:①N2+3H22NH3;②N2+O22NO。根据图中的数据判断下列说法正确的是
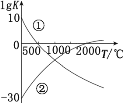
A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
D.曲线的交点表示反应①和反应②体系中 N2 的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是( )
A.探究AgCl和AgI之间的转化 
B.比较Cl2、Br2、I2的氧化性强弱 ![]()
C.制备Fe(OH)2 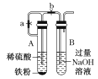
D.用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
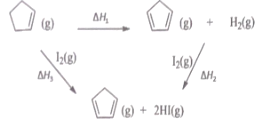
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 溶液,下列各项中正确的是
溶液,下列各项中正确的是![]()
![]()
A.![]()
B.水解离子方程式:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.升高温度,水解平衡逆向移动
D.向溶液中加入少量醋酸钠固体,平衡正向移动,醋酸钠的水解程度![]() 即转化率
即转化率![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com