
【题目】含氮化合物的用途广泛。 下图表示两个常见固氮反应的平衡常数的对数值(lgK)与温度的关系:①N2+3H22NH3;②N2+O22NO。根据图中的数据判断下列说法正确的是
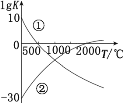
A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
D.曲线的交点表示反应①和反应②体系中 N2 的浓度一定相等
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。回答下列问题:
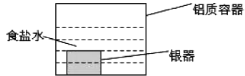
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于__________腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为__________极,银器的电极反应式为____________。
(3)处理过程中总反应的化学方程式为_______________。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
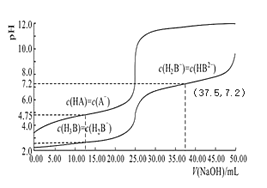
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业排放的烟气中的SO2是大气的一次污染物之一,同时也是雾篮天气的重要前体物。工业上常用氨水吸二氧化硫气体。常温时,向10mL0.1molL-l的氨水中通入SO2,SO2体积(标准状况)与溶液pH的关系如图所示(忽略溶液体积变化)。
已知:25℃时,NH3H2O的Kb=l.7×l0-5,H2SO3的Ka1=l.3×10-2,Ka2=6.2×l0-8。
回答下列问题:
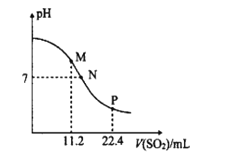
(1)M点溶液中阴离子浓度由大到小的顺序为__,![]() __(填>、=或<)2。
__(填>、=或<)2。
(2)N点溶液中的溶质为__(填化学式),c(NH4+):c(HSO3-)=__。
(3)水的电离程度M点__P点(填“大于”、“小于”或“等于”)。
(4)反应NH3H2O+H2SO3![]() NH4++HSO3-+H2O的平衡常数K=__。
NH4++HSO3-+H2O的平衡常数K=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如下图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
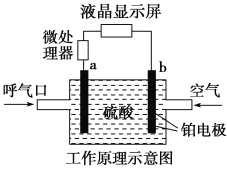
A.电解质溶液中的H+移向a电极
B.b为正极,电极反应式为:O2+4H++4e-=2H2O
C.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
D.呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素L、X、Y、Z、W的原子序数依次递增,其中只有一种金属元素, L和Y、X和Z分别同主族,由X、Y、Z三种元素形成的化合物M结构如图所示,在工业上用作漂白剂等。下列叙述正确的是 ( )

A.简单离子半径:Z>W>Y>X>L
B.化合物M可用作氧化剂
C.Z、W的氧化物对应的水化物均为强酸
D.X、Z、W可分别与Y形成含有非极性共价键的二元离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是
A.pH 相等的盐酸和醋酸,加水稀释相同倍数后,c(Cl-)=c(CH3COO- )
B.0.l molL-1 氨水的p H= a,加入适量的氯化铵固体可使溶液pH= a+ l
C.物质的量浓度相等的 (NH4)2SO4 溶液与(NH4) 2CO3溶液中, 前者大于后者
前者大于后者
D.等物质的量浓度等体积的醋酸溶液和氢氟酸溶液,与足量氢氧化钠反应,放出的热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中,不正确的是( )
A.一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1NA
B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜
C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA
D.标准状况下,锌与某浓度的H2SO4反应生成11.2 L气体,反应中转移的电子数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com