
【题目】NA表示阿伏加德罗常数的值。下列说法中,不正确的是( )
A.一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1NA
B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜
C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA
D.标准状况下,锌与某浓度的H2SO4反应生成11.2 L气体,反应中转移的电子数为6.02×1023
【答案】B
【解析】
A.2.3 g Na与氧气反应时,无论生成Na2O还是Na2O2,Na的化合价均是从0价升高到+1价,Na失去电子![]() =0.1 mol,数目为0.1NA,A正确;
=0.1 mol,数目为0.1NA,A正确;
B.由于电解精炼时阳极为粗铜,同时有其他杂质溶解,所以电路中转移NA个电子时溶解的铜小于0.5mol×64g/mol=32 g,B错误;
C.通入氯气首先与I-反应,即当Fe2+参与反应时,I-已经完全与氯气反应,所以该过程中碘离子反应转移电子数0.4NA,Fe2+反应转移电子数0.1NA,共转移电子数0.5NA,C正确;
D.标准状况下,锌与某浓度的H2SO4反应不论生成SO2还是H2,每生成1 mol都转移2mol电子,D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】含氮化合物的用途广泛。 下图表示两个常见固氮反应的平衡常数的对数值(lgK)与温度的关系:①N2+3H22NH3;②N2+O22NO。根据图中的数据判断下列说法正确的是
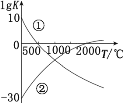
A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
D.曲线的交点表示反应①和反应②体系中 N2 的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水醋酸镁为白色粉末,易潮解,易溶于水,熔点323℃,熔融时同时分解,常用作烯烃聚合催化剂,制备方法如下。
制法一:将80%醋酸用水稀释后,水浴加热至60~ 80℃,在搅拌下分批少量加入碳酸镁至CO2不再逸出为止,继续加热,趁热过滤。在滤液中补充适量醋酸,......,得到四水醋酸镁晶体,....,.即得无水醋酸镁
(1)碳酸镁需分批少量加入,理由是____________________。
(2)滤液中补充适量醋酸的目的是_____________________。
(3)从下列提供的操作中选择必要的操作(可重复使用),将制法一中“……”处的步骤补充完整,正确的顺序是 _________,_______。 (填编号)
制法二 :将六水硝酸镁与醋酸酐混合加热,发生反应:(具体步骤略去)
2Mg(NO3)26H2O+ 14(CH3CO )2O![]() 2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
(4)用七水硫酸镁代替六水硝酸镁按相同操作进行制备实验,无法得到产品,原因是 __________________。
(5)以铬黑T(BET)为指示剂 ,用 EDTA测定Mg2+含量的原理用方程式可表示为:
EDTA (无色)+Mg-BET (紫红)= BET (蓝色)+ Mg-EDTA (无色)
为测定产品纯度,称取试样0.3000 g 于锥形瓶中,加入100ml 蒸馏水,待完全溶解后加入l 0mLpH=l 0的氨-氯化铁缓冲溶液,溶液变浑浊,再滴加3~ 4 滴铬黑 T 指示剂 (BET),用0. l 000molL-1 的 EDTA标准溶液滴定至终点,重复上述操作两次平均消耗 EDTA 标准溶液 20.50mL。
①滴定终点的现象为_______________ 。
②产品中镁元素的质量分数为________(保留四位有效数字)。
(6)下列关于该实验的操作或分析 ,正确的是__________(填编号)。
A. 用倾析法将固液混合物转移至布氏漏斗中进行抽滤时,先转移溶液再转移沉淀
B. 称取一定质量的产品时,若电子天平未调整水平,则称得的产品偏多
C. 开始滴定前,滴定管尖悬挂的液滴需擦去,否则可能引起结果偏低
D. 根据(5)的测定方法可知,Mg(OH)2可溶于EDTA溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如图:


已知:![]()
(1)A中的官能团名称为___。
(2)D→E的反应类型为___。
(3)B的分子式为C9H14O,写出B的结构简式:___。
(4) 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和
和 为原料制备
为原料制备![]() 的合成路线流程图___(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 溶液,下列各项中正确的是
溶液,下列各项中正确的是![]()
![]()
A.![]()
B.水解离子方程式:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.升高温度,水解平衡逆向移动
D.向溶液中加入少量醋酸钠固体,平衡正向移动,醋酸钠的水解程度![]() 即转化率
即转化率![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于该物质,下列说法正确的是()
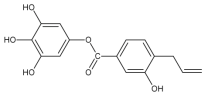
A.1mol该物质最多与8mol H2发生加成反应
B.1mol该物质最多与5mol Br2反应
C.1mol该物质最多与6mol NaOH发生反应
D.可以用酸性高锰酸钾溶液检验该物质中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示,下列说法错误的是()
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示,下列说法错误的是()
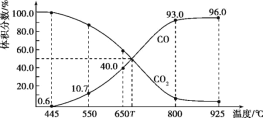
A.550 ℃时,若充入惰性气体,v正、v逆均减小,平衡向正反应方向移动
B.650 ℃时,反应达平衡后CO2的转化率为25.0%
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx(主要是NO和NO2)是环境保护的重要课题。
(1)用Pl-g-C3N4光催化氧化法脱除NO的过程如图-1所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应:O2+2H++2e-=H2O2,Pl端的反应:___。

(2)次氯酸盐脱除NO的主要过程如下:
①NO+HClO=NO2+HCl
②NO+NO2+H2O![]() 2HNO2
2HNO2
③HClO+HNO2=HNO3+HCl
下列分析正确的是___。
a.烟气中含有的少量O2能提高NO的脱除率
b.NO2单独存在时不能被脱除
c.脱除过程中,次氯酸盐溶液的pH下降
(3)NaClO溶液能有效脱除NO。25℃时,NO的脱除率随pH的变化如图-2所示;pH=4时,NO的脱除率随温度的变化如图-3所示。
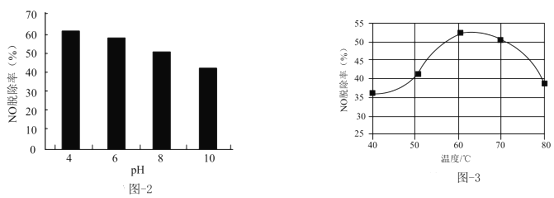
①25℃时,随着pH降低,NO的脱除率增大的原因:___。
②pH=4时,60~80℃NO的脱除率下降的原因:___。
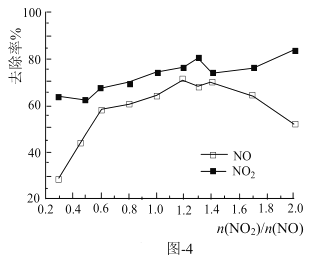
(4)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图-4所示。
,NOx的去除率如图-4所示。
已知:NO与Ca(OH)2不反应;
NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是___。
大于1.4时,NO2去除率升高,但NO去除率却降价。其可能的原因是___。
③O3与NO反应的方程式为:NO+O3=NO2+O2,(该条件下不考虑O2与NO的反应)。保持NO的初始浓度不变,改变n(O3)/n(NO),将反应后的混合气体通入Ca(OH)2悬浊液中吸收。为节省O3的用量,又能保持NOx总去除效果好,则![]() 合适的值范围为___。(保留两位小数)
合适的值范围为___。(保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com