
【题目】化学反应A(g)+3B(g)![]() 2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是
2C(g)+2D(g),在下列四个选项中是不同的情况下测得的不同物质的反应速率,其中表示该化学反应的反应速率最快的是
A.υ(A)=0.2mol(L·min)B.υ(B)=0.45 mol(L·s)
C.υ(C)=0.40 mol(L·min)D.υ(D)=0.35 mol(L·min)
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2↑+_____H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________,
②乙二酸分解的化学方程式为 ________;
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______(用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,
时,![]() 及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )

A. 溶液的pH=5时,硫元素的主要存在形式为![]()
B. 当溶液恰好呈中性时: c(Na+)>c(HSO3-)+c(SO32-)
C. 向pH=8的上述溶液中滴加少量澄清石灰水, 的值增大
的值增大
D. 向pH=3的上述溶液中滴加少量稀硫酸,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 钢铁发生吸氧腐蚀时,铁做负极被氧化 Fe-2e- = Fe2+
B. Na2CO3 溶液显碱性 CO32-+2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
C. 氯气通入NaOH溶液得到漂白液 Cl2 + 2OH- = Cl- + ClO- + H2O
D. 向Mg(OH)2悬浊液中滴加FeCl3溶液,生成Fe(OH)3 :3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3↓+3Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
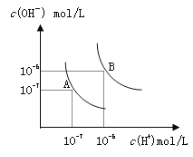
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C. 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D. 25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚CH3OCH3又称甲醚,熔点-141.5℃,沸点-24.9℃。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.0 kJ·mol-1
CH3OH(g) △H1 =-90.0 kJ·mol-1
②2CH3OH(g) ![]() CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
回答下列问题:
(1)反应①在_____________(填“低温”或“高温”)下易自发进行。
(2)写出由合成气(CO、H2)直接制备CH3OCH3的热化学方程式:______________。
(3)温度为500K时,在2L的密闭容器中充入2mol CO和6molH2发生反应①、②,5min时达到平衡,平衡时CO的转化率为60%,c(CH3OCH3) = 0.2 mol·L-1,用H2表示反应①的速率是________,反应②的平衡常数K =____________。
(4)研究发现,在体积相同的容器中加入物质的量相同的CO和H2发生反应①、②,在不同温度和有无催化剂组合下经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO转化(%) | CH3OCH3选择性(%) |
473 | 无 | 10 | 36 |
500 | 无 | 12 | 39 |
500 | Cu/ZnO | 20 | 81 |
(备注)二甲醚选择性:转化的CO中生成CH3OCH3百分比
①相同温度下,选用Cu/ZnO作催化剂,该催化剂能_______ (填标号)。
A.促进平衡正向移动 B.提高反应速率 C.降低反应的活化能
D.改变反应的焓变 E.提高CO的平衡转化率
②表中实验数据表明,在500K时,催化剂Cu/ZnO对CO转化成CH3OCH3的选择性有显著的影响,其原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期实验目的是()
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为____________________B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关K与b连接,下列说法正确的是________(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
且此时装置内总反应的离子方程式为_____________________________________________________
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为_________________________________________,此时通过阴离子交换膜的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。
用惰性电极电解体积为1L的CuSO4溶液,当阴阳极都产生3.36L(标况)气体时,请问硫酸铜的浓度为______,若要此溶液恢复到原状态需要加入________(填选项)
A.CuSO4 B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com