
����Ŀ������A��B����������֪A�ķ���ʽΪC5Hmht��B�����ʽΪC5Hn(m��n��Ϊ������)����ش��������⣺
��1�����й�����A����B��˵������ȷ���� (�����)��
a.��A����B���ܻ�Ϊͬϵ��
b.��A����B���ܻ�Ϊͬ���칹��
c.��m=12ʱ����Aһ��Ϊ����
d.��n=11ʱ����B���ܵķ���ʽ��2��
��2������AΪ�������ҷ���������̼ԭ�Ӷ���ͬһ��ֱ���ϣ���A�Ľṹ��ʽΪ ��
��3������AΪ�������ҷ���������̼ԭ��һ�����棬��һ�������£�1 mol A������1 mol H2�ӳɣ���A�������� ��
��4������BΪ����ͬϵ�ȡһ��������B��ȫȼ�պ���������ͨ��������Ũ���ᣬŨ�������������1.26 g����ͨ�������ļ�ʯ�ң���ʯ�ҵ���������4.4 g������B�ķ���ʽΪ �����䱽���ϵ�һ�����ֻ��һ�֣�����ϴ���������B�� �֡�
���𰸡���1�� d�� ��2��CH��C��C��C��CH3�� ��3��3-��-2-��ϩ�� ��4��C10H14
�������������������1��a����A����B���ܻ�Ϊͬϵ���AΪC5H10��BΪC10H20��ϩ����a��ȷ��b����n=mʱ����B�ķ���ʽ��A��ͬ����A��B��Ϊͬ���칹�壬b��ȷ��c������������Hԭ����Cԭ����Ŀ֮�ȴ���2��1ʱ����Ϊ��������m=12ʱ��AΪ���飬c��ȷ��D����n=11ʱ��B�ķ���ʽΪC10H22��Ϊ���飬��ԭ�����Ѿ���࣬���Է���ʽֻ��1�֣�d����ѡd��
��2����H-C��C-H��4��ԭ�ӹ��߿�֪��Ҫʹ��A��5��̼ԭ�ӹ��ߣ�����������A�ķ����б�����2��-C��C-������A�Ľṹ��ʽΪCH��C��C��C��CH3��
��3������A��H2��������ʵ���֮��1��1�ӳɣ���AΪϩ��C5H10��̼̼˫�������6��ԭ�ӹ�ƽ�棬����������̼ԭ�Ӷ���ͬһ��ֱ���ϣ���A�Ľṹ��ʽΪ2������2����ϩ��
��4���������⣬n��CO2��="4.4g��44g/mol=0.1" mol��n��H2O��="1.26g��18g/mol=0.07" mol��������B�����ʽΪC5H7��BΪ����ͬϵ���B�ķ���ʽΪCaH2a-6��a����2a-6��=5��7�����a=10��B����ʽΪC10H14���䱽���ϵ�һ�����ֻ��һ�֣���������������У�
 ����4�֡�
����4�֡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʽṹ�����ʣ��±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�

�Իش��������⣺
��1����д��Ԫ��N�Ļ�̬ԭ�ӵ����Ų�ʽ ��
��2��Ԫ��B��G�γɵĵ����۵���ߵ���_ ___���ѧʽ����ԭ����____ _
��3��ME2L2������Ϊ���ɫҺ�壬����CCl4��CS2�Ȼ��ܣ��ݴ˿��ж�ME2L2��__________�����������������Ǽ����������ӡ�
��4������������CH3OH����HCHO����CS2����CCl4�����л��ܼ��У�̼ԭ�Ӳ�ȡsp2�ӻ��ķ�����___________������ţ���CS2���ӵĿռ乹����__________��
��5��Ԫ��N�����γɷ���ʽΪCo(NH3)5BrSO4,��λ����Ϊ6������������������һ����������Һ�м���BaCl2��Һʱ������������������AgNO3��Һʱ����������ɫ��������������Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.����˵������ȷ���� ��
A����ϩ��������8���Ҽ���1���м�
B����SiO2�����У�1��Siԭ�Ӻ�2��Oԭ���γ�2�����ۼ�
C��NF3�ķе��NH3�ķе�͵ö࣬����ΪNH3���Ӽ��������NF3ֻ�з��»���
D��NCl3��BC13�����У�����ԭ�Ӷ�����sp3�ӻ�
II.������ʹ�ý�������ʷ�����У�������ͭ��������֮�����ֽ����㷺Ӧ�õĽ�������ѧ��Ԥ������(Ti)��������Ϊ��δ�����͵Ľ��������Իش��������⣺
��1��TiԪ����Ԫ�����ڱ��е�λ���ǵ�______���ڵ�___ ____����
���̬ԭ�ӵĵ����Ų�ʽΪ________��
��2����Ti�Ļ������У����Գ��֣�2����3����4���ֻ��ϼۣ������ԣ�4�۵�Ti��Ϊ�ȶ���ƫ���ᱵ�����ȶ��Ժã���糣���ߣ���С�ͱ�ѹ������Ͳ���������ж���Ӧ�ã�ƫ���ᱵ�����о����Ľṹʾ��ͼ��ͼ��ʾ�����Ļ�ѧʽ�� ������Ti4��������λ��Ϊ ��Ba2��������λ��Ϊ ��

��3�������µ�TiCl4���д̼��Գ�ζ����ɫ��Һ�壬�۵�-23.2�����е�136.2��������TiCl4Ӧ�� ������������ ���塣TiCl4�ڳ�ʪ�������ӷ���ˮ���ð���̣�������Ϊˮ�����________���ɡ�
��4����֪Ti3�����γ���λ��Ϊ6��������ռ乹��Ϊ�������壬����ͼ1��ʾ������ͨ����������ͼ2��ʾ�ķ�������ʾ��ռ乹�ͣ�����A��ʾ���壬M��ʾ����ԭ�ӣ�����λ������[Co(NH3)4Cl2]�Ŀռ乹��ҲΪ�������ͣ����� ��ͬ���칹�壬������ͼ�����н��仭����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ð�Һ������ӡˢп��ʱ����ϡ���ḯʴп���õ��ġ���Һ��(����������Cl����Fe3��)��ij��ѧ��ȤС�����á��ð�Һ����ȡZn(NO3)2��6H2O�Ĺ������£�

��֪��Zn(NO3)2��6H2O��һ����ɫ���壬ˮ��Һ�����ԣ�Zn(NO3)2����Ӧ���õ��IJ���������ԡ�
��1�����ð�Һ�������ʵ���Ҫ�ɷ���______(�ѧʽ����ͬ)��
��2�����������Ҫ�ɷ���____________��
��3���������м�����е�Ŀ����_____________���˲�����������������_______________��
��4�������ܱ���pH��2��Ŀ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҹ�������������ŷŵķ�����ʯ����ȡ���Ტ����ˮ��ļ����о���óɹ�����֪��ʯ����Ҫ�ɷ���Ca3��PO4��2����������������ͼ��

�ش��������⣺
��1��װ��a����������NH3�����ù�����ʵ�����н��У��뻭��װ��a��ʾ��ͼ��_____��
��2���Ƚ�������ʵ�����Ƚ�����װ�á���ѧʵ����Ҳ���������Ƚ�����ʵ��ij��ʵ��Ŀ�ģ�������Һ�Ƚ���ʱͨ��ʹ�õ�������_______________��
��3��������²����A��һ�����е����ʵĻ�ѧʽ��___________���ᾧˮ���ֲ�д����
��4��������������ŷŵķ�����ʯ����ȡ���ᣬ����SO2��������Ĺ�������ͼ��ͼ��ʾ��

����A�������������������������豸A��������___________���豸A�з�����Ӧ�Ļ�ѧ����ʽ��______________��Ϊ�����������IJ��ʣ��ô�Ӧ����_____������¹��̡����ȹ��̡���Ϊ�ˡ�
����D�����ж��δ�������ԭ����_______________________��
��B������������Ҫ�ǵ�������������ʱ���徭��C����������D����Ϊ��___________��
��20%�ķ������ᣨSO3����������Ϊ20%��1�����ˮ_______�֣�����2λ��Ч���֣��������Ƴ�98%�ij�Ʒ���ᡣ
��5����������������β�����˺���N2��O2�⣬������SO2������SO3�������������ڲⶨ����β����SO2��������___________________��
A��NaOH��Һ����̪��Һ B��KMnO4��Һ��ϡ����
C����ˮ��������Һ D����ˮ����̪��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��![]() H��
H��![]() H����O2��O3������������CH3CH2 CH2 CH3�����춡��
H����O2��O3������������CH3CH2 CH2 CH3�����춡��![]() ����������CH4���������C3H8����
����������CH4���������C3H8����
��1����Ϊͬλ�ص���______ ������ţ���ͬ���� ��2����Ϊͬϵ�����______��
��3����Ϊͬ���칹�����______�� ��4����Ϊͬ�����������______��
II.A��E�ȼ��������ӵ����ģ������ͼ��ʾ���ݴ˻ش��������⡣

��1��D�ĵ���ʽΪ___________��A�Ķ���ȡ������ �֡�
��2������Ϊֲ���������ڼ����� ����ṹ��ʽ����
��3��A��������Ӧ�������ɶ������ʣ�����д����һ����Ӧ�Ļ�ѧ����ʽ�� ��
��4��C��ˮ��һ�������·�Ӧ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��ӻ����� PPTA ��֬��PF ��֬����ȩ��֬�ϳ�·�����¡�

��֪��I.
II.![]() ����������ԭ���ϵ���ԭ�ӿ������ϵ���ԭ���������ȩ�����ӳɷ�Ӧ�������۳ɸ߷��ӡ�
����������ԭ���ϵ���ԭ�ӿ������ϵ���ԭ���������ȩ�����ӳɷ�Ӧ�������۳ɸ߷��ӡ�
��1��![]() ��B �ķ�Ӧ������____________________��
��B �ķ�Ӧ������____________________��
��2������aѡ��Ļ�ѧ�Լ���____________________��
��3��E�������ֲ�ͬ��ѧ��������ԭ�ӣ�PPTA ��֬�Ľṹ��ʽ��____________________��
��4��W��ֻ��һ�ֺ��������š�����˵����ȷ����____________��
a��Y������ֻ��һ�ֹ�����
b��M��HCHO ��Ϊͬϵ��
c��W�ķе����C2H6
��5��Y��W ʱ������������ת���Ĺ����ŷֱ���____________��____________��
��6���ϳ���ȩ��֬�Ļ�ѧ����ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������һ�������Դ,��������ȡ�봢��������Դ����������о��ȵ㡣
��֪:CH4(g)+H2O(g)��CO(g)+3H2(g) ��H=+206.2 kJ��mol-1
CH4(g)+CO2(g)��2CO(g)+2H2(g) ��H=+247.4 kJ��mol-1
2H2S(g)��2H2(g)+S2(g) ��H=+169.8 kJ��mol-1
�Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ ��
��2��Na2S��ˮ��Һϴ������������������һ��С�����Ƥ�������������Ƥ��������������ˮ���Ƶ�Na2S��Һ����Ч�����á���˵��ԭ�� ����д���йصĻ�ѧ����ʽ ��
��3��ij����ˮ�к���Ca2����Mg2����Na+��K+��HCO��SO��Cl��������������������ˮ���ڹ�¯���γ�ˮ������¯ˮ�������ķ�ȼ�ϣ��������ջ���¯��Σ�գ����Ҫ���������¯ˮ����
��֪��������20 ��ʱ���ܽ�����ݣ�
���� | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
�ܽ��/(g/100 g H2O) | 9.0��10-4 | 1.5��10-3 | 1.0��10-2 | 1.7��10-1 | 2.1��10-1 | 26.7 |
�����û�ѧ����ʽ��ʾ��¯�е�ˮ������Mg(OH)2��ԭ��______________________��
����¯�е�ˮ�������е�CaSO4����ֱ�������ȥ����Ҫ�����Լ�X��ʹ��ת��Ϊ���������������Y����ȥ���Լ�X��________(�����)��
A.ʳ�� B.�Ȼ��� C.̼���� D.̼������
CaSO4��ת��Ϊ����Y��ԭ����(����������) _______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ�������粒����������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��![]() 2NH3(g)+CO2(g)��
2NH3(g)+CO2(g)��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
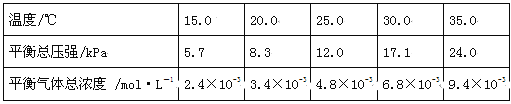
�������жϸ÷ֽⷴӦ�Ѿ��ﵽƽ����� �������ţ�
A��2v(NH3)=v(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�����ݱ������ݣ���ʽ����25.0��ʱ�ķֽ�ƽ�ⳣ���� ��
��ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒�������� (����������������������������������
����������立ֽⷴӦ���ʱ���H 0(������������=����������)���ر���S 0(������������=����������)��
��2����֪��NH2COONH4+2H2![]() NH4HCO3+NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO������ʱ��ı仯������ͼ��ʾ��
NH4HCO3+NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO������ʱ��ı仯������ͼ��ʾ��

����25.0��ʱ��0��6min ���������ˮ�ⷴӦ��ƽ������ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com