
 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1mol |
| 2L |
| 1mol |
| 2L |
| 1mol |
| 2L |
| 0.5 |
| 0.5×(0.5)2 |
| 1 |
| 2 |
| 2.8×10-9 |
| 3.5×10-4 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
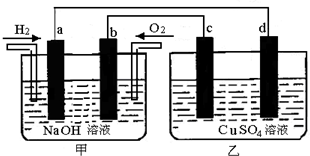
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
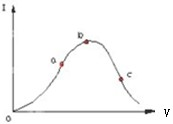 醋酸是一种弱电解质.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
醋酸是一种弱电解质.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①④⑤ |
| C、②④⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COOH) |
| B、c(H+) |
| C、c(OH-) |
| D、c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com