
【题目】(1)为除去CuSO4溶液中少量的Fe3+杂质,可加入某物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3而除去,调整溶液pH可选用下列物质中的________。
A. NaOH B. Cu C. Cu(OH)2 D. NH3·H2O
(2)在恒温、恒容条件下,将1molA和2molB充入一个密闭容器中,在一定条件下发生反应:A(g)+2B(g)![]() xC(g),达到平衡时,测得C的物质的量分数为m%;若开始充入容器中的是0.3mol A、0.6mol B和1.4mol C,达平衡时C的物质的量分数仍为m%,则x的值为_________________ 。
xC(g),达到平衡时,测得C的物质的量分数为m%;若开始充入容器中的是0.3mol A、0.6mol B和1.4mol C,达平衡时C的物质的量分数仍为m%,则x的值为_________________ 。
(3)25℃时,物质的量浓度相同的下列六种溶液:①NH3·H2O ②NH4HSO4 ③(NH4)2CO3 ④NH4Cl ⑤NH4Al(SO4)2 ⑥(NH4)2SO4 ,其中c(NH4+)从大到小的排列顺序为______________(填序号)。
(4)已知下列四组溶液中:①Na2S ② H2S 和NaHS ③H2S ④NaHS ,每种溶质的物质的量浓度均为0.4 mol·L-1,回答下列问题:
c(H2S)从大到小的顺序为____________________________(填序号)
c(S2-)从大到小的顺序为_____________________________(填序号)
【答案】 C 2或3 ⑥>③>②>⑤>④>① ②>③>④>① ①>④>②>③
【解析】(1)调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,则C符合,A、D将铜离子转化为沉淀,不符合,B中Cu与Fe3+反应生成了Fe2+,引入了新杂质,不符合,故答案为: C;
(2)恒温恒容下,开始充入2molA和1molB与开始充入0.6molA、0.3molB和1.4molC达到平衡后,C的体积分数为m%,说明为完全等效平衡,按化学计量数转化到左边,满足n(A)=2mol、n(B)=1mol,故0.6mol+![]() =2mol,解得x=2,但是对于反应前后气体系数和相等的反应,物质的投料等比即等效,所以x=3也是正确的,故答案为:2或3;
=2mol,解得x=2,但是对于反应前后气体系数和相等的反应,物质的投料等比即等效,所以x=3也是正确的,故答案为:2或3;
(3)设物质的量浓度聚为1mol/L。①NH3·H2O为弱碱,电离程度很小,c(NH4+)很小;②④⑤三者中c(NH4+)都约为1mol/L,④NH4Cl中氯离子对铵根离子的水解无影响;②NH4HSO4中氢离子抑制铵根离子的水解;⑤NH4Al(SO4)2中铝离子的水解抑制铵根离子的水解,但抑制程度小于②;则c(NH4+)②>⑤>④;③⑥二者c(NH4+)都约为2mol/L,③(NH4)2CO3中碳酸根离子的水解促进铵根离子的水解;⑥(NH4)2SO4中硫酸根离子对铵根离子的水解无影响,则c(NH4+)⑥>③,因此c(NH4+)从大到小的排列顺序为⑥>③>②>⑤>④>①,故答案为:⑥>③>②>⑤>④>①;
(4)③H2S、②H2S和NaHS中存在大量硫化氢分子,且硫化氢的电离程度越大,则硫化氢浓度越小,则硫化氢浓度大小为:③<②; ④NaHS、①Na2S二者溶液中硫化氢浓度减小,硫氢根离子水解生成硫化氢,则②中数据生成的硫化氢浓度大于③,所以四种溶液中硫化氢浓度大小为:②>③>④>①;①Na2S中S2-水解程度较小,c(S2-)≈c(Na2S),最大;③H2S中S2-为二级电离产生的,电离程度非常小,c(S2-)最小;②④中S2-为NaHS电离产生的,但②中H2S和NaHS溶液的酸性比④大,抑制NaHS的电离,c(S2-):④>②,故四种溶液的c(S2-)从大到小的顺序为:①>④>②>③;故答案为:②>③>④>①;①>④>②>③。


科目:高中化学 来源: 题型:
【题目】元素周期表短周期的一部分如图所示.下列有关A,B,C,D,E五种元素的叙述中,正确的是( ) 
A.D在过量的B中燃烧的主要产物为DB3
B.C的氢化物的水溶液酸性比E的强
C.A与B形成的阴离子可能有AB32﹣、A2B42﹣
D.原子半径:A>B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅属于酸性氧化物,理由是
A. Si是非金属元素 B. SiO2对应的水化物是可溶性弱酸
C. SiO2与强碱反应生成盐和水 D. SiO2不能与酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和盐类水解无关的是
A. 热的纯碱溶液去油污能力强 B. 用饱和FeCl3溶液制备Fe (OH)3胶体
C. NaHSO4水溶液显酸性 D. 施肥时,草木灰和铵态氮肥不能混合施用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨炸弹爆炸时,能在方圆几百米范围内撒下大量的石墨纤维,造成输电线、电厂设备损坏。这是由于石墨
A. 有剧毒 B. 易燃、易爆 C. 能导电 D. 有放射性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH ![]() CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2mL 95%的乙醇,在一干燥的三颈烧瓶中放入12mL 95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12mL浓硫酸,使混合均匀,并加入2粒沸石.实验装置如图:将反应瓶放在电热套上加热,使温度迅速地上升到140℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140℃之间.待乙醇加完后,继续反应10min,直到温度上升到160℃止.关闭热源,停止反应.
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8mL 15% NaOH溶液、8mL饱和食盐水洗涤,最后再用8mL饱和氯化钙溶液洗涤2次,充分静置后分液.将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥.待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38℃的馏分.
请根据上述信息,完成下列问题: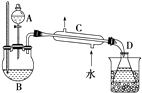
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是 , 如果实验中忘记加沸石,需要怎么处理? .
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同?(填“是”或“否”),原因是
(3)仪器C的名称为 .
(4)如果温度太高,将会发生副反应,产物是 .
(5)精制乙醚中,加入15% NaOH溶液的作用是 , 加入饱和氯化钙溶液的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关中和滴定的操作:
①用标准液润洗滴定管;
②往滴定管内注入标准溶液;
③检查滴定管是否漏水;
④滴定;
⑤滴加指示剂于待测液;
⑥洗涤.
正确的操作顺序是( )
A.⑥③①②⑤④
B.⑤①②⑥④③
C.⑤④③②①⑥
D.③①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图.下列说法正确的是( ) 
A.CO、SO2、SO3均是酸性氧化物
B.图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH,原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Br-、Cl-、CrO42- B. Cl-、Br-、CrO42-
C. CrO42-、Br-、Cl- D. Br-、CrO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com