
ĄŸÌâÄżĄżÄłÍŹŃ§ÓĂÈçÍŒËùÊŸŚöËźčû”çłŰ”ÄÊ”Ńé,Čâ”ĂÊęŸĘÈçϱíËùÊŸŁș
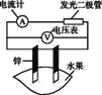
ÊÔŃé±àșĆ | ”猫ČÄÁÏ | ËźčûÆ·ÖÖ | ”猫ŒäŸà/cm | ”çŃč/mV | |
1 | Đż | Í | Č€ÂÜ | 3 | 900 |
2 | Đż | Í | Æ»čû | 3 | 650 |
3 | Đż | Í | žÌœÛ | 3 | 850 |
4 | Đż | Í | ÎśșìÊÁ | 3 | 750 |
5 | Đż | ÂÁ | Č€ÂÜ | 3 | 650 |
6 | Đż | ÂÁ | Æ»čû | 3 | 450 |
Çë»ŰŽđÒÔÏÂÎÊÌâŁș
Łš1Ł©Ê”Ńé6ÖĐžșŒ«”Ĕ猫·ŽÓŠÊœÎȘ____ĄŁ
Łš2Ł©Ê”Ńé1Ąą5ÖĐ”çÁś·œÏòÏà·Ž”ÄÔÒòÊÇ____ĄŁ
Łš3Ł©Ó°ÏìËźčû”çłŰ”çŃč”ÄÒòËŰÓĐ_____Ąą____ĄŁ
Łš4Ł©ÈôÔÚÊ”ŃéÖĐ·ąčâ¶țŒ«čÜČ»ÁÁŁŹžĂ͏ѧÓĂÍĄąĐżŚś”猫ŁŹÓĂČ€ÂÜŚśœéÖÊŁŹČąœ«¶àžöŽË”çłŰŽźÁȘÆđÀŽŁŹÔٜӷąčâ¶țŒ«čÜŁŹŐâŃùŚö____ĄŁ(ÌșÏÀíĄ±»òĄ°Č»șÏÀíĄ±)
ĄŸŽđ°žĄżAl-3e-=Al3+ Ê”ŃéąÙÖĐĐż±ÈÍ»îÆĂŁŹĐżŚśžșŒ«ŁŹÊ”ŃéąĘÖĐÂÁ±ÈĐż»îÆĂŁŹĐżŚśŐęŒ«ŁŹÁœÊ”ŃéÖĐ”çÁś·œÏòÏà·Ž ËźčûÆ·ÖÖ ”猫ČÄÁÏ șÏÀí
ĄŸœâÎöĄż
Łš1Ł©ĐżĄąÂÁșÍËźčûĐÎłÉÔ”çłŰʱŁŹÂÁÒŚÊ§”çŚÓŚśžșŒ«ŁŹĐżŚśŐęŒ«Ł»
Łš2Ł©ĐγɔÄÔ”çłŰÖĐŁŹœÏ»îÆĂ”ÄœđÊôÒŚÊ§”çŚÓ¶űŚśžșŒ«Ł»
Łš3Ł©žùŸĘÍŒ±íÖĐœđÊôĄą”猫șÍ”çŃč”ÄčŰÏ”·ÖÎöŁ»
Łš4Ł©œ«¶àžöŽË”çłŰŽźÁȘÆđÀŽŁŹÔöŽó”çŃ裏ĄŁ
Łš1Ł©Ê”Ńé6ÖĐ”çŒ«ÊÇÂÁ±ÈĐżÓëÂÁ»îÆĂŁŹÂÁÎȘžșŒ«ŁŹ·ŽÓŠÊœÎȘAl-3e-=Al3+Ł»
Łš2Ł©Ê”Ńé1ÖĐĐż±ÈÍ»îÆĂŁŹĐżÎȘžșŒ«ŁŹÊ”Ńé5ÖĐÂÁ±ÈĐż»îÆĂŁŹĐżÎȘŐęŒ«ŁŹčÊÁœÊ”ŃéÖĐ”çÁś·œÏòÏà·ŽŁ»
Łš3Ł©ÓÉÊ”Ńé1șÍ5żÉÖȘ,Ëźčû”çłŰ”Ä”çŃčÓëËźčû”ÄÆ·ÖÖŒ°”猫ČÄÁÏÓĐčŰĄŁ
Łš4Ł©œ«¶àžöŽË”çłŰŽźÁȘÆđÀŽŁŹÔöŽó”çŃ裏Ôٜӷąčâ¶țŒ«čÜŁŹŐâŃùŚöșÏÀíĄŁ


 ĂûĐŁżÎÌĂÏ”ÁĐŽđ°ž
ĂûĐŁżÎÌĂÏ”ÁĐŽđ°ž
| Äꌶ | žßÖĐżÎłÌ | Äꌶ | łőÖĐżÎłÌ |
| žßÒ» | žßÒ»Ăâ·ŃżÎłÌÍÆŒöŁĄ | łőÒ» | łőÒ»Ăâ·ŃżÎłÌÍÆŒöŁĄ |
| žß¶ț | žß¶țĂâ·ŃżÎłÌÍÆŒöŁĄ | łő¶ț | łő¶țĂâ·ŃżÎłÌÍÆŒöŁĄ |
| žßÈę | žßÈęĂâ·ŃżÎłÌÍÆŒöŁĄ | łőÈę | łőÈęĂâ·ŃżÎłÌÍÆŒöŁĄ |
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÉèÄłÔȘËŰÔŚÓșËÄÚ”ÄÖÊŚÓÊęÎȘmŁŹÖĐŚÓÊęÎȘnŁŹÔòÏÂÁĐÂÛÊöŐęÈ·”ÄÊÇŁš Ł©
A.Č»ÄÜÓÉŽËÈ·¶šžĂÔȘËŰ”ÄÔŚÓÁż
B.ŐâÖÖÔȘËŰ”ÄÔŚÓÁżÎȘŁšm+nŁ©
C.ÈôÌŒÔŚÓ”ÄÖÊÁżÎȘw gŁŹŽËÔŚÓ”ÄÖÊÁżÎȘŁšm+nŁ©w g
D.șËÄÚÖЌӔČÜÖÊÁżĐĄÓÚÖÊŚÓ”ÄŚÜÖÊÁż
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÒŃÖȘ25ĄæʱŁŹRSO4(s)+CO32-(aq)RCO3(s)+SO42-(aq)”ÄÆœșⳣÊęK=1.75ĄÁ104ŁŹKsp(RCO3)=2.80ĄÁ10-9ŁŹÏÂÁĐĐđÊöÖĐŐęÈ·”ÄÊÇ
A.25Ąæ ʱŁŹRSO4”ÄKspÔŒÎȘ4.9ĄÁ10-5
B.œ«Ćš¶ÈŸùÎȘ6ĄÁ10-5mol/L”ÄRCl2ĄąNa2CO3ÈÜÒș”ÈÌć»ę»ìșÏșóżÉ”Ă”œRCO3łÁ”í
C.Ïòc(CO32-)=c(SO42-)”Ä»ìșÏÒșÖĐ”ÎŒÓRCl2ÈÜÒșŁŹÊŚÏÈÎöłöRSO4łÁ”í
D.Ïà͏ζÈÏÂŁŹRCO3ÔÚËźÖĐ”ÄKspŽóÓÚÔÚNa2CO3ÈÜÒșÖĐ”ÄKsp
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÒ»ÖÖŒŚŽŒĄąŃőÆűșÍÇżŒîÈÜÒșŚö”çœâÖÊ”ÄĐÂĐÍÊÖ»ú”çłŰŁŹżÉÁŹĐűÊčÓĂÒ»žöÔÂŁŹÆä”çłŰ·ŽÓŠÎȘŁș2CH3OH+3O2+4OH©![]() 2CO32©+6H2OŁŹÔòÓĐčŰË”·šŐęÈ·”ÄÊÇ Łš Ł©
2CO32©+6H2OŁŹÔòÓĐčŰË”·šŐęÈ·”ÄÊÇ Łš Ł©
AŁź·Ć”çʱCH3OHČÎÓë·ŽÓŠ”Ĕ猫ÎȘŐęŒ«
BŁź·Ć”çʱžșŒ«”Ĕ猫·ŽÓŠÎȘCH3OH+8OH©©6e©=CO32©+6H2O
CŁź±êŚŒŚŽżöÏÂŁŹÍšÈë5.6LO2ČąÍêÈ«·ŽÓŠșóŁŹÓĐ0.5mol”çŚÓŚȘÒÆ
DŁź·Ć”çÒ»¶ÎʱŒäșóŁŹÍšÈëŃőÆű”Ĕ猫žœœüÈÜÒș”ÄpHœ””Í
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
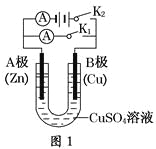
ĄŸÌâÄżĄżÇë°ŽÒȘÇó»ŰŽđÏÂÁĐÎÊÌ⥣
 ĄĄ
ĄĄ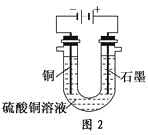
(1)žùŸĘÍŒ1»ŰŽđąÙąÚŁș
ąÙÈô¶ÏżȘK2ŁŹ±ŐșÏK1ĄŁ
A”猫żÉčÛČ씜”ÄÏÖÏó________________________________________________Ł»
BŒ«”Ĕ猫·ŽÓŠÊœÎȘ__________________________________________________ĄŁ
ąÚÈô¶ÏżȘK1ŁŹ±ŐșÏK2ŁŹA”猫żÉčÛČ씜”ÄÏÖÏóÊÇ________________Ł»BŒ«”Ĕ猫·ŽÓŠÊœÎȘ____________ĄŁ
(2)žùŸĘÍŒ2»ŰŽđąÛąÜŁș
ąÛœ«œÏŽżŸ»”ÄCuSO4ÈÜÒș·ĆÈëÈçÍŒËùÊŸ”ÄŚ°ÖĂÖĐœűĐĐ”çœâŁŹÊŻÄ«”猫ÉϔĔ猫·ŽÓŠÊœÎȘ________________ŁŹ”çœâ·ŽÓŠ”ÄÀëŚÓ·œłÌÊœÎȘ________________ĄŁ
ąÜÊ”ŃéÍêłÉșóŁŹÍ”猫ÔöÖŰa gŁŹÊŻÄ«”猫ČúÉú±êŚŒŚŽżöÏ”ÄÆűÌćÌć»ę________LĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÒ»¶šÎ¶ÈÏÂŁŹÏòÒ»žöÒ»¶šÈĘ»ę”ÄĂܱŐÈĘÆśÖĐ·ĆÈë3 mol XșÍ2 mol YŁŹ·ąÉú·ŽÓŠŁșX(g)Ł«Y(g)![]() 2Z(g)Ł«R(g)ŁŹŽïÆœșâʱX”ÄŚȘ»ŻÂÊÎȘŠŐ1ĄŁÎŹłÖζÈČ»±äŁŹÈô°Ń6 mol XșÍ3 mol Y·ĆÈëžĂÈĘÆśÖĐŁŹŽïÆœșâʱX”ÄŚȘ»ŻÂÊÎȘŠŐ2ŁŹÔòŠŐ1ÓëŠŐ2”ÄčŰÏ”ÊÇ(ĄĄĄĄ)
2Z(g)Ł«R(g)ŁŹŽïÆœșâʱX”ÄŚȘ»ŻÂÊÎȘŠŐ1ĄŁÎŹłÖζÈČ»±äŁŹÈô°Ń6 mol XșÍ3 mol Y·ĆÈëžĂÈĘÆśÖĐŁŹŽïÆœșâʱX”ÄŚȘ»ŻÂÊÎȘŠŐ2ŁŹÔòŠŐ1ÓëŠŐ2”ÄčŰÏ”ÊÇ(ĄĄĄĄ)
A.ŠŐ1>ŠŐ2B.ŠŐ1<ŠŐ2C.ŠŐ1ŁœŠŐ2D.ÎȚ·šĆжÏ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄżÄłżÎÍâĐĄŚé·Ö±đÓĂÈçÍŒËùÊŸŚ°ÖöÔÔ”çłŰșÍ”çœâÔÀíœűĐĐÊ”ŃéÌœŸżĄŁ

Çë»ŰŽđŁș
ąńŁźÓĂÍŒ 1 ËùÊŸŚ°ÖĂœűĐĐ”ÚÒ»ŚéÊ”Ń饣
Łš1Ł©ÔÚ±ŁÖ€”猫·ŽÓŠČ»±ä”ÄÇéżöÏÂŁŹČ»ÄÜÌæŽú Cu Śś”猫”ÄÊÇ__ŁšÌîŚÖÄžĐòșĆŁ©ĄŁ
A ÂÁ B ÊŻÄ« C Òű D ČŹ
Łš2Ł©N Œ«·ąÉú·ŽÓŠ”Ĕ猫·ŽÓŠÊœÎȘ__ĄŁ
ąòŁźÓĂÍŒ 2 ËùÊŸŚ°ÖĂœűĐДڶțŚéÊ”ŃéĄŁÊ”ŃéčęłÌÖĐŁŹčÛČ씜Óë”ÚÒ»ŚéÊ”ŃéȻ͏”ÄÏÖÏóŁșÁœŒ«ŸùÓĐÆűÌćČúÉúŁŹYŒ«ÇűÈÜÒșÖđœ„±äłÉŚÏșìÉ«Ł»ÍŁÖčÊ”Ń飏Ìú”çŒ«ĂśÏÔ±äÏžŁŹ”çœâÒșÈÔÈ»łÎÇ楣 ČéÔÄŚÊÁÏ”ĂÖȘŁŹžßÌúËážùÀëŚÓŁšFeO42-Ł©ÔÚÈÜÒșÖĐłÊŚÏșìÉ«ĄŁ
Łš3Ł©”çœâčęłÌÖĐŁŹX Œ«ÇűÈÜÒș”Ä pH__ŁšÌÔöŽóĄ±Ą°ŒőĐĄĄ±»òĄ°Č»±äĄ±Ł©ĄŁ
Łš4Ł©”çœâčęłÌÖĐŁŹY Œ«·ąÉú”Ĕ猫·ŽÓŠÖźÒ»ÎȘ Fe©6e©+8OH©= FeO42-+4H2O ÈôÔÚ X Œ«ÊŐŒŻ”œ672 mL ÆűÌ棏ÔÚ Y Œ«ÊŐŒŻ”œ 168 mL ÆűÌ棚ŸùÒŃŐÛËăÎȘ±êŚŒŚŽżöʱÆűÌćÌć»ęŁ©ŁŹÔò Y ”猫ŁšÌú”猫Ł©ÖÊÁżŒőÉÙ____gĄŁ
Łš5Ł©ÔÚŒîĐÔĐż”çłŰÖĐŁŹÓĂžßÌúËáŒŰŚśÎȘŐęŒ«ČÄÁÏŁŹ”çłŰ·ŽÓŠÎȘ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2ŁŹžĂ”çłŰŐęŒ«·ąÉú”Ä·ŽÓŠ”Ĕ猫·ŽÓŠÊœÎȘ__ĄŁ
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
ĄŸÌâÄżĄż”Ș”ÄŃő»ŻÎï(NOx)ÊÇŽóÆűÎÛÈŸÎïÖźÒ»ŁŹč€Ò”ÉÏÔÚÒ»¶šÎ¶ÈșÍŽß»ŻŒÁÌőŒțÏÂÓĂNH3œ«NOx»čÔÉúłÉN2ŁŹÄłÍŹŃ§ÔÚÊ”ŃéÊÒÖжÔNH3ÓëNOx·ŽÓŠœűĐĐÁËÌœŸżĄŁ»ŰŽđÏÂÁĐÎÊÌâŁș
Łš1Ł©°±Æű”ÄÖƱž

ąÙ°±Æű”Ä·ąÉúŚ°ÖĂżÉÒÔŃĄÔńÉÏÍŒÖĐ”Ä________ŁŹ·ŽÓŠ”Ä»ŻŃ§·œłÌÊœÎȘ______________ĄŁ
ąÚÔ€ÊŐŒŻÒ»ÆżžÉÔï”Ä°±ÆűŁŹŃĄÔńÉÏÍŒÖДČ°ÖĂŁŹÆäÁŹœÓËłĐòÎȘŁș·ąÉúŚ°ÖĂĄú______(°ŽÆűÁś·œÏòŁŹÓĂĐĄĐŽŚÖÄž±íÊŸ)ĄŁ
Łš2Ł©°±ÆűÓë¶țŃő»Ż”Ș”Ä·ŽÓŠœ«ÉÏÊöÊŐŒŻ”œ”ÄNH3łäÈ댹ÉäÆśXÖĐŁŹÓČÖÊČŁÁ§čÜYÖĐŒÓÈëÉÙÁżŽß»ŻŒÁŁŹłäÈëNO2(Áœ¶ËÓĂŒĐŚÓK1ĄąK2ŒĐșĂ)ĄŁÔÚÒ»¶šÎ¶ÈÏ°ŽÍŒÊŸŚ°ÖĂœűĐĐÊ”Ń饣

ČÙŚśČœÖè | Ê”ŃéÏÖÏó | œâÊÍÔÒò |
ŽòżȘK1ŁŹÍƶŻŚąÉäÆś»îÈûŁŹÊčXÖĐ”ÄÆűÌć»șÂęÍšÈëYčÜÖĐ | ąÙYčÜÖĐ_____________ | ąÚ·ŽÓŠ”Ä»ŻŃ§·œłÌÊœ ____________ |
œ«ŚąÉäÆś»îÈûÍË»ŰÔŽŠČąč̶šŁŹŽęŚ°Öû֞Ž”œÊÒΠ| YčÜÖĐÓĐÉÙÁżËźÖé | ÉúłÉ”ÄÆűÌŹËźÄęŒŻ |
ŽòżȘK2 | ąÛ_______________ | ąÜ______________ |
Č鿎Žđ°žșÍœâÎö>>
żÆÄżŁșžßÖĐ»ŻŃ§ ÀŽÔŽŁș ÌâĐÍŁș
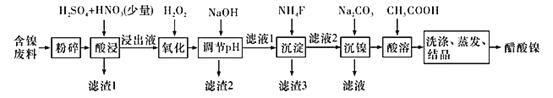
ĄŸÌâÄżĄżŽŚËáÄű[(CH3COO)2Ni]ÊÇÒ»ÖÖÖŰÒȘ”Ä»Żč€ÔÁÏĄŁÒ»ÖÖÒÔșŹÄű·ÏÁÏ(șŹNiSĄą Al2O3ĄąFeOĄąCaOĄąSiO2 )ÎȘÔÁÏŁŹÖÆÈĄŽŚËáÄű”Äč€ÒŐÁśłÌÍŒÈçÏÂŁș
ÏàčŰÀëŚÓÉúłÉÇâŃő»ŻÎï”ÄpHșÍÏàčŰÎïÖÊ”ÄÈÜœâĐÔÈç±íŁș
œđÊôÀëŚÓ | żȘÊŒłÁ”í”ÄpH | łÁ”íÍêÈ«”ÄpH | ÎïÖÊ | 20Ąæʱ”ÄÈÜœâĐÔ(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | ÎąÈÜ |
Fe2+ | 5.8 | 8.8 | NiF2 | żÉÈÜ |
Al3+ | 3.0 | 5.0 | CaF2 | ÄŃÈÜ |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60ĄÁ10-6 |
(1)·ÛËéșŹÄű·ÏÁÏ”ÄŚśÓĂÊÇ__________ĄŁ
(2)ËáœțčęłÌÖĐŁŹ1molNiSʧȄ6NAžö”çŚÓŁŹÍŹÊ±ÉúłÉÁœÖÖÎȚÉ«ÓжŸÆűÌ楣ЎłöžĂ·ŽÓŠ”Ä»ŻŃ§·œłÌÊœŁș_____________ĄŁ
(3)ĐŽłöŃő»ŻČœÖèÖĐŒÓÈëH2O2·ąÉú·ŽÓŠ”ÄÀëŚÓ·œłÌÊœŁș________ĄŁ
(4)”śœÚpHłęÌúĄąÂÁČœÖèÖĐŁŹÈÜÒșpH”Ä”śœÚ·¶Î§ÊÇ________ĄŁ
(5)ÂËÔü3ÖśÒȘłÉ·Ö”Ä»ŻŃ§ÊœÊÇ_________ĄŁ
(6)łÁÄűčęłÌÖĐŁŹÈôc(Ni2+ )=2.0 molĄ€L-1ŁŹÓûÊč100 mLžĂÂËÒșÖĐ”ÄNi2+łÁ”íÍêÈ«[c(Ni2+)ĄÜ10-5 molĄ€L-1]ŁŹÔòĐèÒȘŒÓÈëNa2CO3čÌÌć”ÄÖÊÁżŚîÉÙÎȘ___________g(±ŁÁô1λХÊę)ĄŁ
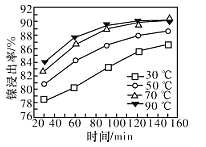
(7)±ŁłÖÆäËûÌőŒțČ»±äŁŹÔÚȻ͏ζÈ϶ÔșŹÄű·ÏÁÏœűĐĐËáœțŁŹÄűœțłöÂÊËæʱŒä±ä»ŻÈçÍŒĄŁËáœț”ÄŚîŒŃζÈÓëʱŒä·Ö±đÎȘ______ĄæĄą_______minĄŁ
Č鿎Žđ°žșÍœâÎö>>
čúŒÊѧУÓĆŃĄ - Á·Ï°ČáÁбí - ÊÔÌâÁбí
șț±±ÊĄ»„ÁȘÍű΄·šșÍČ»ÁŒĐĆÏąŸÙ±šÆœÌš | ÍűÉÏÓĐșŠĐĆÏąŸÙ±šŚšÇű | ”çĐĆŐ©ÆŸÙ±šŚšÇű | ÉæÀúÊ·ĐéÎȚÖśÒćÓĐșŠĐĆÏąŸÙ±šŚšÇű | ÉæÆóÇÖÈšŸÙ±šŚšÇű
΄·šșÍČ»ÁŒĐĆÏąŸÙ±š”ç»°Łș027-86699610 ŸÙ±šÓÊÏäŁș58377363@163.com