
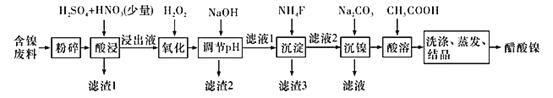
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、 Al2O3、FeO、CaO、SiO2 )为原料,制取醋酸镍的工艺流程图如下:
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时的溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)粉碎含镍废料的作用是__________。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:________。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是________。
(5)滤渣3主要成分的化学式是_________。
(6)沉镍过程中,若c(Ni2+ )=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为___________g(保留1位小数)。
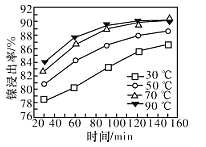
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为______℃、_______min。
【答案】加快化学反应速率,提高镍的浸出率 NiS +H2SO4 + 2HNO3 = NiSO4 + SO2↑+ 2NO↑+ 2H2O 2 Fe3+ + H2O2 + 2H+ = 2Fe3+ + 2H2O 5.0 ≤pH < 6.7 CaF2 31.4g 70 120
【解析】
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0 ≤pH < 6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体。
(1)粉碎含镍废料的作用是加快化学反应速率,提高镍的浸出率;故答案为:加快化学反应速率,提高镍的浸出率。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体,则为NO和SO2,其反应的化学方程式为:NiS +H2SO4 + 2HNO3 = NiSO4 + SO2↑+ 2NO↑+ 2H2O;故答案为:NiS +H2SO4 + 2HNO3 = NiSO4 + SO2↑+ 2NO↑+ 2H2O。
(3)溶液中的亚铁离子不容易转化为沉淀,加H2O2把亚铁离子氧化为Fe3+,反应的离子方程式为:2 Fe3+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;故答案为:2 Fe3+ + H2O2 + 2H+ = 2Fe3+ + 2H2O。
(4)调节pH除铁、铝步骤中,要将Fe3+、Al3+除尽,但不能除掉Ni2+,因此溶液pH的调节范围是5.0 ≤pH < 6.7;故答案为:5.0 ≤pH < 6.7。
(5)由流程以及物质的溶解性分析可知,滤渣3主要成分的化学式是CaF2;故答案为:CaF2。
(6)沉镍过程中,已知NiCO3的Ksp=9.60×10-6,先Na2CO3沉淀Ni2+生成NiCO3,100mL溶液中c(Ni2+ )=2.0 mol·L-1,n(Ni2+ )= 2.0 mol·L-1×0.1L =0.2mol,消耗n(Na2CO3)=0.2mol,则Na2CO3溶液中再将Ni2+沉淀完全,即c(Ni2+)≤10-5 mol·L-1,![]() ,消耗n(Na2CO3)= 0.96 mol·L-1×0.1L =0.096 mol,共消耗n(Na2CO3)= 0.2mol + 0.096 mol=0.296mol,即质量m(Na2CO3) = 0.296mol×106gmol-1 = 31.4g;故答案为:31.4g。
,消耗n(Na2CO3)= 0.96 mol·L-1×0.1L =0.096 mol,共消耗n(Na2CO3)= 0.2mol + 0.096 mol=0.296mol,即质量m(Na2CO3) = 0.296mol×106gmol-1 = 31.4g;故答案为:31.4g。
(7)根据图像分析可知,70℃和90℃在120min时差不多,而再延长时间,镍浸出率增加不大,因此酸浸的最佳温度与时间分别为70℃、120min。


科目:高中化学 来源: 题型:
【题目】某同学用如图所示做水果电池的实验,测得数据如下表所示:
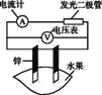
试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑桔 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
请回答以下问题:
(1)实验6中负极的电极反应式为____。
(2)实验1、5中电流方向相反的原因是____。
(3)影响水果电池电压的因素有_____、____。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做____。(填“合理”或“不合理”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图量一套检验气体性质的实验装置。向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是 ( )

A | B | C | D | |
X | 硫化氢 | 二氧化硫 | 二氧化碳 | 氯化氢 |
Y | 浓硫酸 | 饱和NaHCO3 | Na2SO3溶液 | 饱和NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
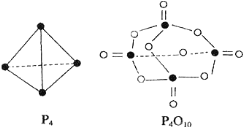
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在工农业生产、生活中有着重要作用,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则H2=_________。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是_______(填序号)。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=________________,该温度下反应的平衡常数K=_______________。(答案可用分数表示)
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是_________。
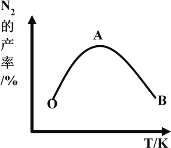
(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是__________(填序号)。
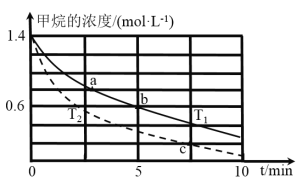
A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学反应方程式:
反应Ⅰ:N2H4(g)![]() N2(g)+2H2(g) ΔH1
N2(g)+2H2(g) ΔH1
反应Ⅱ:N2(g)+3H2(g)![]() 2NH3(g) ΔH2
2NH3(g) ΔH2
(1)ΔH1__ΔH2(填“<”、“>”或“=”)。
(2)7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
8NH3(g)+3N2(g)+2H2(g) ΔH=__(用ΔH1、ΔH2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成高效、低毒农药杀灭菊酯(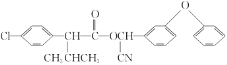 )流程如下:
)流程如下:
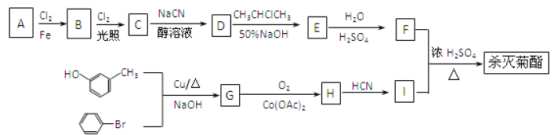
已知:
①R—X![]() RCN
RCN![]() RCOOH
RCOOH
②![]()
![]()
![]()
③![]()
![]()
![]()
④当苯环上连卤原子时,高温高压可以水解。
回答下列问题:
(1)按照系统命名法命名,B的名称是____;合成G的反应类型是________。
(2)有关A的下列说法正确的是________(填字母代号)。
a.A的所有原子可能处在同一平面上
b.A的核磁共振氢谱有5个峰
c.充分燃烧等质量的A和环己烷消耗氧气的量相等
d.A与苯互为同系物
e.A能使酸性KMnO4溶液褪色
(3)写出C在高温高压条件下与足量氢氧化钠水溶液充分反应的化学方程式:__________。
(4)写出反应F+I→杀灭菊酯的化学方程式:_______。
(5)H与银氨溶液水浴加热的离子方程式为:________。
(6)D在硫酸存在下发生水解生成J,符合下列要求的J的同分异构体有______种,并写出J的核磁共振氢谱为2: 2: 2: 1的所有结构简式:________。
①苯环上有两个取代基;②能水解成两种有机物;③可以发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在800K时,反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6 mol·L-1,试求CO转化为CO2的转化率____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A. 电解池的阳极上发生氧化反应,阴极上发生还原反应
B. 原电池跟电解池连接后,电子从电池负极流向电解池阳极
C. 电镀时,电镀池里的阳极材料发生氧化反应
D. 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com