
【题目】如图量一套检验气体性质的实验装置。向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是 ( )

A | B | C | D | |
X | 硫化氢 | 二氧化硫 | 二氧化碳 | 氯化氢 |
Y | 浓硫酸 | 饱和NaHCO3 | Na2SO3溶液 | 饱和NaHCO3 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】已知25℃时,RSO4(s)+CO32-(aq)RCO3(s)+SO42-(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是
A.25℃ 时,RSO4的Ksp约为4.9×10-5
B.将浓度均为6×10-5mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C.向c(CO32-)=c(SO42-)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设KCl的摩尔质量为a g/mol, 20℃时某KCl饱和溶液的物质的量浓度为b mol/L,该溶液的密度为ρg/cm3 (ρ﹥1),下列说法不正确的是( )
A.20℃ KCl的溶解度为100ab/(1000ρ-ab) g
B.KCl的质量分数为(ab/1000ρ)×100%
C.将此溶液蒸发部分水再恢复到20℃,溶液密度一定大于ρ g/cm3
D.20℃密度小于ρ g/cm3的KCl溶液是不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
Ⅰ.请写出BaSO4能作为钡餐透视的另外一个理由:__。
Ⅱ.请用文字叙述和离子方程式说明钡餐透视时为什么不用BaCO3?__。
Ⅲ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水 ②20mL0.5mol·L-1的Na2SO4溶液 ③40mL0.2mol·L-1的Ba(OH)2溶液 ④40mL0.1mol·L-1的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是__,BaSO4的溶解度的大小顺序为__(填序号)。
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为__,溶液②中c(Ba2+)为__。
(3)某同学取同样的溶液③和溶液④直接混合,则混合溶液的pH为__(假设混合后溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(T℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__;此溶液中各离子的浓度由大到小的排列顺序是_____。
(2)若所得混合溶液的pH=2,则a∶b=____;此溶液中各种离子的浓度由大到小的排列顺序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、 Al2O3、FeO、CaO、SiO2 )为原料,制取醋酸镍的工艺流程图如下:
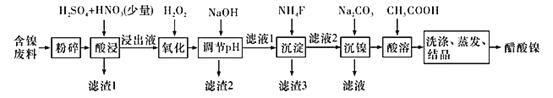
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时的溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)粉碎含镍废料的作用是__________。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:________。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是________。
(5)滤渣3主要成分的化学式是_________。
(6)沉镍过程中,若c(Ni2+ )=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为___________g(保留1位小数)。
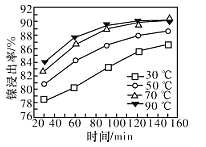
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为______℃、_______min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲萘醌(维生素K)有止血作用,它可通过α-甲基萘的氧化制得,反应中常用乙酸作催化剂,该反应放热,可表示为:
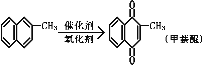
在某次合成反应中,用1.4g(0.01mol)的α-甲基萘,才制得0.17g(0.001mol)甲萘醌,已知该反应的速率是快的。试判断导致其产率低的原因是( )
A.使用了过量的催化剂B.没有用乙酸,而是使用其它催化剂
C.把反应混合物加热D.所生成的甲基醌是沉淀物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com