
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհף�
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
��1������ЩԪ���У���ѧ��������õ��ǣ��������Ԫ�ط��ţ���ͬ����ԭ�ӽṹʾ��ͼΪ �� Ԫ�آ�����Ϊ�����ڱ��е�λ�� ��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ�� �� ������ǿ�Ļ�����ĵ���ʽ�ǣ� ��
��3���õ���ʽ��ʾԪ�آ���Ļ�������γɹ��̣� �� �û���������������ۡ������ӡ��������
��4����ʾ����ߵĻ�����ĵ���ʽ �� �û���������������ԡ������Ǽ��ԡ������γɵģ�
��5���ۡ��ޡ�������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳���� ��
��6��Ԫ�آ۵��⻯��ĽṹʽΪ�����⻯�ﳣ���º�Ԫ�آߵĵ��ʷ�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��Ar��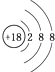 ���壻�������ڵڢ�A��
���壻�������ڵڢ�A��
��2��HClO4��![]()
��3��![]() ������
������
��4��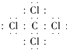 ������
������
��5��S2����Cl����O2��
��6��H��O��H��Cl2+H2O�THClO+HCl
���������⣺��Ԫ�������ڱ���λ�ã���֪��ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪS����ΪCl����ΪAr����ΪK����ΪBr����1��ϡ������Ar��ѧ�������ȶ���ԭ�Ӻ�����18�����ӣ���3�����Ӳ㣬���������Ϊ2��8��8��ԭ�ӽṹʾ��ͼΪ  ��Ԫ�آ�λ�ڵ������ڵڢ�A�壬Ϊ��Ԫ�أ� ���Դ��ǣ�Ar��
��Ԫ�آ�λ�ڵ������ڵڢ�A�壬Ϊ��Ԫ�أ� ���Դ��ǣ�Ar��  ���壻�������ڵڢ�A�壻��2�����������ˮ�����У�������ǿ�Ļ�������HClO4 �� ������ǿ�Ļ�������KOH���ɼ����������������ӹ��ɣ�����ʽΪ��
���壻�������ڵڢ�A�壻��2�����������ˮ�����У�������ǿ�Ļ�������HClO4 �� ������ǿ�Ļ�������KOH���ɼ����������������ӹ��ɣ�����ʽΪ�� ![]() �����Դ��ǣ�HClO4��
�����Դ��ǣ�HClO4�� ![]() ����3������Ļ�����ΪNa2S���õ���ʽ��ʾ�γɹ���Ϊ
����3������Ļ�����ΪNa2S���õ���ʽ��ʾ�γɹ���Ϊ ![]() ���������ӻ�������Դ��ǣ�
���������ӻ�������Դ��ǣ� ![]() �����ӣ���4������ߵĻ�����ΪCCl4 �� ������̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�����ʽΪ
�����ӣ���4������ߵĻ�����ΪCCl4 �� ������̼ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ�����ʽΪ 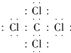 ��̼ԭ�ӡ���ԭ�ӶԹ��õ��Ӷ�������ͬ�����ڼ��Լ������Դ��ǣ�
��̼ԭ�ӡ���ԭ�ӶԹ��õ��Ӷ�������ͬ�����ڼ��Լ������Դ��ǣ� 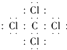 �����ԣ���5�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶Ϊ��S2����Cl����O2�� �� ���Դ��ǣ�S2����Cl����O2������6��Ԫ�آ۵��⻯��ΪH2O����������ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH��O��H����������Ӧ����HCl��HClO����Ӧ����ʽΪ��Cl2+H2O�THClO+HCl��
�����ԣ���5�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶Ϊ��S2����Cl����O2�� �� ���Դ��ǣ�S2����Cl����O2������6��Ԫ�آ۵��⻯��ΪH2O����������ԭ������ԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH��O��H����������Ӧ����HCl��HClO����Ӧ����ʽΪ��Cl2+H2O�THClO+HCl��
���Դ��ǣ�H��O��H��Cl2+H2O�THClO+HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mLij���������Ļ��Һ�ֳ����ȷݣ�һ�ݼ��������BaCl2��Һ����ַ�Ӧ��ó���2.33g����һ�ݼ���50mL1.0molL��1NaOH��Һ����ַ�Ӧ����Һ��pH=13����Һ�����Ϊ100mL�����Լ��㣺
��1��ԭ��Һ������H2SO4�����ʵ���mol��
��2��ԭ�����Һ����������ʵ���Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ��ͬѹ�£���ͬ�������ƿ�ֱ�����������Ȼ������壬����Ȫʵ���ˮ��������ƿ����ƿ����Һ�����ʵ���Ũ��֮���ǣ� ��
A.1��0.45
B.1��1
C.1��0.29
D.4.5��2.9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ж�����Ԫ�����ʵ����ݣ����й��ڱ���11��Ԫ�ص�˵����ȷ���ǣ� ��
Ԫ�� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶��10��10m�� | �� | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
����� | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
��2 | ��3 | ��4 | ��1 | ��3 |
A.�ϱ���11��Ԫ�����γɵķǽ������ʶ��зǼ��Թ��ۼ�
B.�ڢᴦ��ͬһ���ڣ��ܢദ��ͬһ����
C.�ϱ���11��Ԫ��������������Ӧ��ˮ�����Тߺ�������ǿ
D.��ԭ�ӽṹʾ��ͼΪ 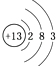
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ���Al2O3 �� ��������SiO2��Fe2O3��MgO����ҵ�ϴ�����������ȡ���ɲ�����ͼ��ʾ�������̣� 
��ش��������⣺
��1��ͼ���漰������Һ�������ʵ�鷽��������������ƣ�����Ҫ�õ��IJ��� ��������
��2������B�ijɷ������ѧʽ����ͬ��������C�ijɷ�������
��3��д��������ҺD�����ӷ���ʽ��
��4������Fת��Ϊ����M�Ļ�ѧ����ʽΪ����ҺD��ͨ�����CO2���ɳ���F�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��нϴ�����Cl����CO32����OH��3�������ӣ����ֻȡһ�θ���Һ���ֱܷ�3�����������μ������������ʵ�����˳�μӵ��Լ�����������ȷ���ǣ� ��
�ٵμ�Mg(NO3)2��Һ�� �ڹ��ˣ� �۵μ�AgNO3��Һ�� �ܵμ�Ba(NO3)2��Һ
A.�٢ڢܢڢ�B.�٢ڢۢڢ�C.�ܢڢ٢ڢ�D.�ܢڢۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2(g)��3H2(g) ![]() 2NH3(g)����H��0������˵����ȷ����(����)
2NH3(g)����H��0������˵����ȷ����(����)
A.�ﵽƽ��ʱ��Ӧ���������Ũ��һ�����
B.���º�ѹʱ�ﵽƽ�����백�������´ﵽƽ��ʱ��������Ũ�ȱ�ԭƽ��ʱ��С
C.�ﵽƽ��ʱ�������¶ȼӿ������ȷ�Ӧ�����ʣ������˷��ȷ�Ӧ�����ʣ����Է�Ӧ���淴Ӧ�ķ����ƶ�
D.��������������̵���ƽ���ʱ�䣬������Ϊ�ӿ�������Ӧ�����ʣ����������淴Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£����백�ϳ����Ļ�������е��������ռ22%�����������ռ78%�����ϳɷ�Ӧ�ﵽƽ�������ͬ�¶Ⱥ�ѹǿ�£����������С��ԭ�����95%��������ת���ʽӽ���(����)
A.11.5%
B.10.5%
C.9.75%
D.13.2%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ĸ��Ǹ����� CH3-C(CH3)2-CH2-CH2-CH2-CH2-CH3������( )
A. 1-��������B. 2-��������C. 6-��������D. 2��2-��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com