
【题目】A、B、C、D均为短周期元素,它们在周期表中的位置如下图。若A原子的最外层电子数是次外层电子数的2倍。下列说法中正确的是

A. D的单质常用做半导体材料
B. 最简单气态氢化物的热稳定性:A>B
C. B的最低负化合价:-2价
D. 原子半径大小:r(C)>r(B)>r(A)
【答案】A
【解析】
A、B、C、D均为短周期元素,A原子的最外层电子数是次外层电子数的2倍,次外层电子数为2,最外层电子数为4,为碳元素;由元素的位置可知,B为氮元素,C为铝元素,D为硅元素,据此分析解答。
根据上述分析,A为碳元素,B为氮元素,C为铝元素,D为硅元素。
A.硅是常见的半导体材料,故A正确;
B.非金属性越强,最简单氢化物越稳定,最简单气态氢化物的热稳定性:A<B,故B错误;
C.氮元素最外层为5个电子,最低负化合价为-3价,故C错误;
D.同一周期,从左到右,原子半径逐渐减小,同一主族,从上到下,原子半径逐渐增大,原子半径大小:r(C)>r(A)>r(B),故D错误;
故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 1∶2 B. 3∶1
C. 2∶1 D. 6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性无色溶液中能大量共存的离子组是的是
A. NH4+、Mg2+、SO42-、Cl-
B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl-
D. Na+ 、Ca2+、Cl -、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有研究人员利用隔膜电解法处理高浓度的乙醛废水转化为乙醇和乙酸。实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法不正确的是

A. 直流电源a端连接的电极发生氧化反应
B. 若以氢氧燃料电池为直流电源,燃料电池的a极应通入H2
C. 反应进行一段时间,右侧电极附近酸性减弱
D. 电解过程中阳极区生成乙酸,阴极区生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3判断下列物质的氧化能力由大到小的顺序是
A. Fe3+ > Cl2 > I2 B. Cl2 > Fe3+ > I2
C. I2 > Cl2 > Fe3+ D. Cl2 > I2 > Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知金属钠的活泼性非常强,甚至在常温时能和水发生反应2Na+2H2O===2NaOH+H2↑。现将9.2克钠、7.2克镁、8.1克铝分别放入100克10.95%的盐酸中,同温同压下产生气体的质量比是( )
A. 1∶2∶3B. 4∶3∶3C. 8∶6∶9D. 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
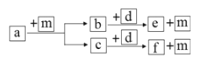
A. 原子半径: W<X<Y<Z
B. 阴离子的还原性: Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a 一定由 W、X 两种元素组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com