
| A���� H2O2+Cl2=2HCl+O2��Ӧ�У�ÿ����32 gO2��ת��4NA������ |
| B��һ�������£�56 g Fe��33.6 L Cl2��ַ�Ӧ��ת�Ƶ�����һ��Ϊ3NA |
| C����״���·�����ΪNA��CO��C2H4����������ԼΪ22.4 L������Ϊ28 g |
| D����1 L 0.2 mol?L-1����������Һ�к��е���������Ϊ0.4NA |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���о���ѧ��������ת����װ�á����̺�Ч�ʵĿ�ѧ�������绯ѧ |
| B����ѧ�������ܡ���ѧ������ܶ�����ͨ����ѧ��Ӧֱ��ת�� |
| C���绯ѧ��Ӧ���̿��Է�Ϊ���������ķ�Ӧ�ͽ��������������ķ�Ӧ���� |
| D���绯ѧ��Ӧ�ð�����⡢��ơ���ұ�𡢵������ȷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����2mol/LAlCl3��Һ��7mol/LNaOH��Һ�������ϣ�2Al3++7OH?=Al��OH��3��+AlO2?+2H2O |
| B��������Һ��ˮ���е�CaCO3��Ӧ��CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2��+H2O |
| C��������������ͨ�����������Һ��SO2+2ClO-+H2O=SO32-+2HClO |
| D������������ϡ���FeS+2H+=H2S��+Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������״����22.4 L��������ˮ���1 L��Һ�����ɵõ�1 mol?L-1�İ�ˮ |
| B��1 mol?L-1�İ�ˮ����������С��1.7% |
| C��1 mol?L-1�İ�ˮ��ˮ��������Ϻ����ð�ˮ�����ʵ���Ũ�ȴ���0.5 mol?L-1 |
| D����1 mol?L-1�İ�ˮ��3 mol?L-1�İ�ˮ��������Ϻ����ð�ˮ�����ʵ���Ũ��Ϊ2 mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Һ���Ȼ�����Һ��Ӧ��Ag++Cl-=AgCl�� |
| B������ϡ���ᷴӦ��2Fe+6H+=2Fe3++3H2�� |
| C��ʯ��ʯ�����ᷴӦ��CO32-+2H+=H2O+CO2�� |
| D������ͭ��Һ������������Һ��Ӧ��2OH-+Cu2+=Cu��OH��2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��8+
| ||
| B��9+lg2 | ||
C��10+
| ||
| D��11+2lg2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
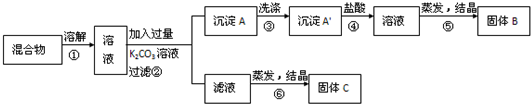
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com