
A、8+
| ||
| B、9+lg2 | ||
C、10+
| ||
| D、11+2lg2 |
|
|
| 2 |
| KW |
| c(OH-) |
| 10-14 | ||
|
| ||
| 2 |
| ||
| 2 |
| 1 |
| 2 |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、等质量的白磷蒸气和白磷固体分别完全燃烧,后者放出的热量多 |
| B、人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的 |
| C、燃烧热是指1mol物质完全燃烧时放出的热量 |
| D、在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在 H2O2+Cl2=2HCl+O2反应中,每生成32 gO2,转移4NA个电子 |
| B、一定条件下,56 g Fe与33.6 L Cl2充分反应,转移电子数一定为3NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、在1 L 0.2 mol?L-1的硫酸铝溶液中含有的铝离子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 |
| B、酸性氧化物都能与水化合生成酸 |
| C、碱性氧化物都能与水化合生成碱 |
| D、碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分解反应 | B、置换反应 |
| C、复分解反应 | D、化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
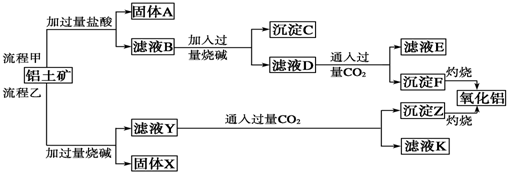
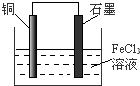
查看答案和解析>>
科目:高中化学 来源: 题型:
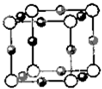 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com