
【题目】在一恒容的密闭容器中充入0.1mol/LCO2、0.1mol/LCH4,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如图,下列有关说法不正确的是( )
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如图,下列有关说法不正确的是( )
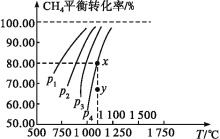
A.上述反应的ΔH>0
B.压强:p4>p3>p2>p1
C.1100℃时该反应平衡常数约为1.64
D.压强为p4时,在y点:v(正)<v(逆)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验操作 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度均为0.1mol/L HClO溶液和CH3COOH溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向10mL浓度均为0.1mol/L的BaCl2和CaCl2混合溶液中加入10mL 0.1mol/L Na2SO4溶液,出现白色沉淀 | 证明Ksp(BaSO4)<Ksp(CaSO4) |
C | 向含有酚酞试液的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
D | 室温下,等体积、pH=2的HA和HB两种酸分别与足量Zn反应,HB放出的H2多 | 证明HB是强酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L 0.1 mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断不正确的是
A.电解质AgNO3溶液的浓度仍为0.l mol/LB.阳极上产生112 mL O2(标况)
C.转移1.204×1022个电子D.反应中有0.02 mol的Ag被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C 时,向 10 mL 0.10 mol·L-1 的 HA (Ka =1.0×10-4)中逐滴加入 0.10 mol·L-1NaOH 溶液,溶液 pH 随滴入的 V[(NaOH)aq]变化如下图所示。下列说法正确的是
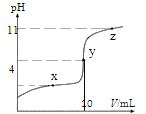
A.x 点,c(HA)> c(A-)
B.y 点,c(HA)+c(A-)=c(Na+) =0.10 mol·L-1
C.z 点,c(Na+) = c(A-) + c(OH-)
D.水的电离程度,x 点小于 y 点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橡皮筋在拉伸和收缩状态时结构如图,在其拉伸过程中有放热现象。25℃、101kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )
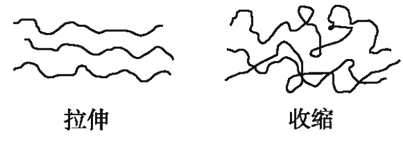
A. CaCO3=CaO+CO2↑
B. NaOH的溶解
C. 2H2+O2=2H2O
D. Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是( )
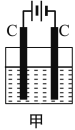
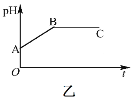
A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.AB线段与BC线段在阴极上发生的反应是相同的,即:Cu2+ + 2e=Cu
C.BC段阴极产物和阳极产物的体积之比为2:1
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一: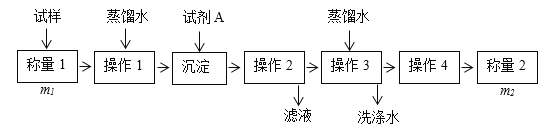
方法二: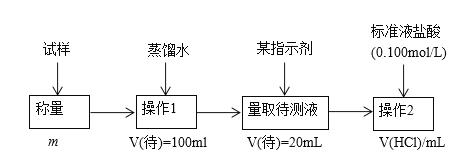
方法三: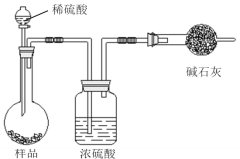
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A______(填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、_______、洗涤和_______;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒外,还需要的用到的是_____,在操作2中应选择的指示剂是____________;
(3)在方法二中计算该样品中NaHCO3的质量分数为___________[用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是________;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是__________,偏低的原因可能是_______(均文字简述);
(6)方法四的实验原理是:_____________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定的![]() 、
、![]() 合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中
合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中![]() 的物质的量( )
的物质的量( )
A.0.01molB.0.02molC.0.03molD.0.04mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图:
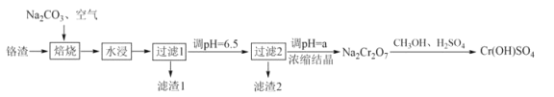
回答下列问题:
(1)“焙烧”时,Cr2O3转化为Na2CrO4的化学方程式为__。
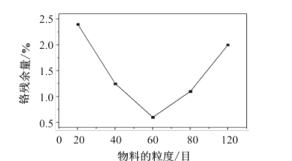
(2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余量的影响如图所示,则最佳反应条件为__。
(3)“滤渣1”中有一种成分为铁铝酸四钙(Ca4Fe2Al2O10),是制造水泥的原料之一,用氧化物的形式表示其化学式__。
(4)“滤渣2”主要成分为Al(OH)3和__(填化学式),“过滤2”后,将溶液pH调至a,a__6.5(填“小于”或“大于”),目的是__(用离子方程式表示)。
(5)已知CH3OH在酸性条件下可被氧化生成CO2,写出Na2Cr2O7与CH3OH反应生成Cr(OH)SO4的化学方程式__。
(6)某厂用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,则产率为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com