
【题目】1 L 0.1 mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断不正确的是
A.电解质AgNO3溶液的浓度仍为0.l mol/LB.阳极上产生112 mL O2(标况)
C.转移1.204×1022个电子D.反应中有0.02 mol的Ag被氧化
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯反应温度为115~125℃,反应装置如下图。下列对该实验的描述错误的是( )
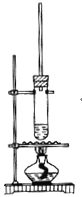
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
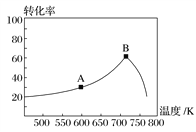
A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
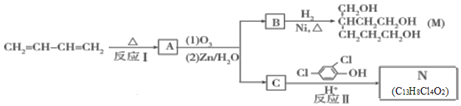
【题目】由1.3-丁二烯可制备醇酸树脂的原料M以及杀菌剂N,其合成路线如图:
已知:i.Diels-AIder反应: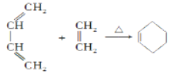
ii.RHC=CHR′![]() RCHO+ R′CHO(R、R′代表羟基或氢)
RCHO+ R′CHO(R、R′代表羟基或氢)
iii.A是一个六元环状化合物;lmol C能与2mol![]() 反应生成N。
反应生成N。
(1)N中含有的官能团名称为_______。
(2)CH2=CH—CH=CH2 能发生加聚反应生成顺式聚合物,请写出该顺式聚合物的结构简式:________。
(3)反应I的化学方程式是__________;该反应的反应类型为_________。
(4)lmol B完全转化成M所消耗的H2的质量是______g。
(5)反应II的化学方程式是________.
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式:_____。
(7)已知:乙快与1, 3-丁二烯也能发生Diels-AIder反应。请以1, 3-丁二烯和乙炔为原料,选用必要的无机试剂合成丙二酸,写出合成路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
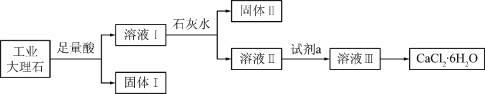
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“麻黄素”是中枢神经兴奋剂,其合成路线如图所示:
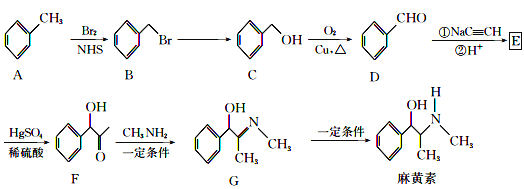
已知:CH3C![]() CH+H2O
CH+H2O![]()
(1)F中的官能团的名称为__。
(2)B→C的反应条件是__,反应类型是__,E的结构简式为__。
(3)写出C→D的化学反应方程式__。
(4)麻黄素的分子式为__。
(5)H是G的同系物,也含醇羟基和碳氮双键,相对分子质量比G小28,且苯环上仅有一个侧链,则H的可能结构有___种(不考虑![]() 结构)。
结构)。
(6)已知:R-C![]() C-R
C-R![]() R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂
R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂![]() 的合成路线,其它试剂及溶剂任选__。
的合成路线,其它试剂及溶剂任选__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上
(1)0.0005 mol/L的氢氧化钡溶液的pH=____________
(2)pH=4的HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol·L-1
(3)pH=4的NH4Cl溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol/L
(4)pH相同的下列溶液:①盐酸、②醋酸,分别与足量且表面积相同的锌片反应,反应起始时生成气体的速率_______(选用“①快”或“②快”或“一样快”或“无法判断”填写),最终生成气体的体积_______。(选用“①多”或“②多”或“一样多”或“无法判断”填写)
(5)用离子方程式表示FeCl3溶液显酸性的原因:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容的密闭容器中充入0.1mol/LCO2、0.1mol/LCH4,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如图,下列有关说法不正确的是( )
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强的关系如图,下列有关说法不正确的是( )
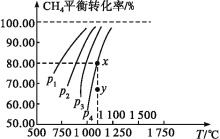
A.上述反应的ΔH>0
B.压强:p4>p3>p2>p1
C.1100℃时该反应平衡常数约为1.64
D.压强为p4时,在y点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com