
����Ŀ���ɶ�����Ԫ����ɵ���ѧ��������A��B��C��D��E��X��������ͼת����ϵ![]() ����������ͷ�Ӧ������ȥ
����������ͷ�Ӧ������ȥ![]() �������ƶϲ���ȷ����
�������ƶϲ���ȷ����
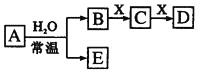
A.��X��![]() ��CΪ�����Լ��ķǼ��Է��ӣ���Aһ���Ƿ����ʣ���D��E����Ӧ
��CΪ�����Լ��ķǼ��Է��ӣ���Aһ���Ƿ����ʣ���D��E����Ӧ
B.��A�ǵ��ʣ�B��D�ķ�Ӧ��![]() ����Eһ���ܻ�ԭ
����Eһ���ܻ�ԭ![]()
C.��DΪCO��C�ܺ�E��Ӧ����Aһ��Ϊ![]() �������ʽ��
�������ʽ��![]()
D.��DΪ��ɫ��������AĦ��������ȣ���Xһ��������
���𰸡�A
��������
A��X��Na2CO3��CΪ�����Լ��ķǼ��Է��ӣ�CΪCO2��BΪǿ�ᣬ��ˮ��Ӧ����ǿ�ᣬ������������ˮ��Ӧ���ɵ�HCl��Ҳ�����Ƕ���������ˮ��Ӧ���ɵ�HNO3��
B������B��D��Ӧ�����ӷ���ʽ![]() ��AΪ���ý���Na��BΪNaOH��EΪH2��XΪCO2��CΪNa2CO3��DΪNaHCO3��
��AΪ���ý���Na��BΪNaOH��EΪH2��XΪCO2��CΪNa2CO3��DΪNaHCO3��
C��DΪCO�������ж�![]() ��XΪC��BΪO2��CΪCO2��A��ˮ��Ӧ����������AΪ�������ƻ��������϶�����̼����E��Ӧ�жϡ�
��XΪC��BΪO2��CΪCO2��A��ˮ��Ӧ����������AΪ�������ƻ��������϶�����̼����E��Ӧ�жϡ�
D��DΪ��ɫ�����������ж�Ϊ![]() ��XΪ���Σ�CΪƫ�����Σ����κ�ƫ����������Һ�з���˫ˮ�ⷴӦ����Al(OH)3��
��XΪ���Σ�CΪƫ�����Σ����κ�ƫ����������Һ�з���˫ˮ�ⷴӦ����Al(OH)3��
A.X��![]() ��CΪ
��CΪ![]() ����AΪ
����AΪ![]() ��BΪ
��BΪ![]() ��EΪNO��DΪ
��EΪNO��DΪ![]() Ҳ����ת����ϵ��A����
Ҳ����ת����ϵ��A����
B.����B��D��Ӧ�����ӷ���ʽ![]() ��AΪ���ý���Na��BΪNaOH��EΪ
��AΪ���ý���Na��BΪNaOH��EΪ![]() ��XΪ
��XΪ![]() ��CΪ
��CΪ![]() ��DΪ
��DΪ![]() ��
��![]() �ڼ���ʱ�ܻ�ԭ
�ڼ���ʱ�ܻ�ԭ![]() ����B��ȷ��
����B��ȷ��
C.��AΪ������HF�������̼����Ӧ��AΪ![]() ��BΪ
��BΪ![]() ��EΪNaOH��XΪC��CΪ
��EΪNaOH��XΪC��CΪ![]() ��DΪCO������ת����ϵ���������Ƶ���ʽΪ��
��DΪCO������ת����ϵ���������Ƶ���ʽΪ��![]() ��C��ȷ��
��C��ȷ��
D.DΪĦ������Ϊ![]() ��
��![]() ��AΪĦ������Ϊ
��AΪĦ������Ϊ![]() ��
��![]() ��XΪ���Σ�CΪƫ�����Σ����κ�ƫ����������Һ�з���˫ˮ�ⷴӦ����
��XΪ���Σ�CΪƫ�����Σ����κ�ƫ����������Һ�з���˫ˮ�ⷴӦ����![]() ������ת����ϵ����D��ȷ��
������ת����ϵ����D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() Ϊ�����ӵ�������ֵ������˵����ȷ����
Ϊ�����ӵ�������ֵ������˵����ȷ����
A.![]() ��
��![]() ���е�������Ϊ
���е�������Ϊ![]()
B.��![]() ��
��![]() �Ļ�����У���������Ϊ
�Ļ�����У���������Ϊ![]()
C.һ�������£�������ѻ�����![]() ��ϩʱ�����Ķ������ĿΪ
��ϩʱ�����Ķ������ĿΪ![]()
D.��֪![]() ��Һ�����ԣ���
��Һ�����ԣ���![]() ��
��![]() ��Һ�к�
��Һ�к�![]() ��ĿΪ
��ĿΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��HA��һԪ���ᣬ25��ʱ�ĵ���ƽ�ⳣ��Ka=4.0��10-8��
��1��д������ĵ��뷽��ʽ___�������ƽ�ⳣ������ʽKa=____��
��2��25��ʱ����1mol��L-1HA��Һ�м���1 mol��L-1 ���ᣬ��____���������������ٽ�����HA�ĵ��룬c(H+)____������������������С���������������� ����ƽ�ⳣ��Ka___������������������С����������������
��3��25��ʱ����HA����ʼŨ��Ϊ0.01mol��L-1����ƽ��ʱc(H+)=___mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ������ЧӦ����Ч;����
��֪��ӦFe��s��+CO2��g��![]() FeO��s��+CO��g����ƽ�ⳣ��ΪK1��
FeO��s��+CO��g����ƽ�ⳣ��ΪK1��
��ӦFe��s��+H2O��g��![]() FeO��s��+H2��g����ƽ�ⳣ��ΪK2��
FeO��s��+H2��g����ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶�ʱK1��K2��ֵ�����
�¶� | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
��1���Ƶ���ӦCO2��g��+H2��g��![]() CO��g��+H2O��g����ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ��___���жϸ÷�Ӧ��____��Ӧ��������������������������
CO��g��+H2O��g����ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ��___���жϸ÷�Ӧ��____��Ӧ��������������������������
II.T1�¶��£����Ϊ2L�ĺ����ܱ�����������4.00molX��4.00molY��������ѧ��ӦX(g)+Y(g)![]() 2M(g)+N(s) ��H<0��
2M(g)+N(s) ��H<0��
����ʵ���������£�
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
��2��ǰ500�룬��Ӧ����v(M)=__ ���÷�����Ӧ��ƽ��K=___��
��3���÷�Ӧ�ﵽƽ��ʱij���������¶ȱ仯��ͼ��ʾ����������Ա�ʾ������������Щ__��

a��Y���淴Ӧ���� b��M���������
c�����������ܶ� d��X��ת����
��4����Ӧ�ﵽƽ������ټ���2.00molM��1.00molN������˵����ȷ����____��
A�����´�ƽ�����X��ʾ��v(��)��ԭƽ���
B�����´�ƽ���M�������������С��50%
C�����´�ƽ���M�����ʵ���Ũ����ԭƽ���1.25��
D�����´�ƽ���Y��ƽ����Ӧ������ԭƽ�����
��5��������Ϊ���Ⱥ�����������ʼʱ����4.00molX��4.00molY�����ƽ���M�����ʵ���Ũ��____2mol/L(��������������С��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O�㷺Ӧ����̫���ܵ��������CuSO4��NaOH�Ϳ���Ѫ��Ϊԭ�ϣ����Ʊ�Cu2O��
(1)Cu2+��̬��������Ų�ʽΪ__��O�Ļ�̬�����Ų�ͼ___��
(2)![]() �Ŀռ乹��Ϊ___(����������)��Cu2+��OH-��Ӧ������[Cu(OH)4]2-��[Cu(OH)4]2-�е���λԭ��Ϊ__(��Ԫ�ط���)��
�Ŀռ乹��Ϊ___(����������)��Cu2+��OH-��Ӧ������[Cu(OH)4]2-��[Cu(OH)4]2-�е���λԭ��Ϊ__(��Ԫ�ط���)��
(3)����Ѫ��ķ��ӽṹ��ͼ1��ʾ��������̼ԭ�ӵĹ���ӻ�����Ϊ__���Ʋ⿹��Ѫ����ˮ�е��ܽ��ԣ�__(����������ˮ������������ˮ��)��
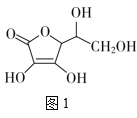
(4)һ��Cu2O����(��ͼ2)�У�Cuԭ�ӵ���ĿΪ___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ�����ĩ������Cu��Cu2O��Fe2O3�е�һ�ֻ��֡�Ϊ̽������ɣ���ȡa g�ù����ĩ��Ʒ���ù�����ϡ�����ַ�Ӧ��(��֪:Cu2O+2H+��Cu2++Cu+H2O)���Ƶù�������Ϊb g���������ƶϲ���������
A. ��Ӧ����Һ�д������ڵ������������3��
B. ��Ӧ�����Һ�м���һ������NaNO3������ʹb g������ȫ�ܽ�
C. ��b��![]() a�����ɫ�����ĩһ��Ϊ������
a�����ɫ�����ĩһ��Ϊ������
D. b��ȡֵ��Χ:0��b��a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾת����ϵ��X����±�أ���˵������ȷ����
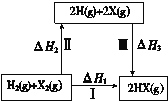
A��2H(g) +2X(g) == 2HX(g) ��H3��0
B��;��������HX�ķ�Ӧ����;���أ����Ԧ�H1 = ��H2 + ��H3
C��Cl��Br��I�ķǽ��������μ���������;�������յ�������������
D��;��������HCl�ų�������������HBr�Ķ࣬˵��HCl��HBr�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L���ܱ������У�һ�������·�����ѧ��Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H= -746.4 kJ��mol-1����ʼ��Ӧʱ NO��CO��Ϊ 4 mol��10 ���Ӻ�ﵽ��ѧƽ�⣬���N2Ϊ1 mol�������йط�Ӧ���ʵ�˵���У���ȷ���ǣ� ��
N2(g)+2CO2(g) ��H= -746.4 kJ��mol-1����ʼ��Ӧʱ NO��CO��Ϊ 4 mol��10 ���Ӻ�ﵽ��ѧƽ�⣬���N2Ϊ1 mol�������йط�Ӧ���ʵ�˵���У���ȷ���ǣ� ��
A. ��Ӧǰ5�����ڣ���NO��ʾ��ƽ����Ӧ����Ϊ0.lmol��L-1��s-1
B. �ﵽƽ������{�¶ȣ�����Ӧ���ʽ���С���淴Ӧ���ʽ�����
C. �ﵽƽ���Ӧ���ʵĹ�ϵ�У�V��(CO)=2v��(N2)
D. ��������������䣬�������г���1 mol O2�������淴Ӧ���ʶ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2C2O4)��һ����Ҫ���л�����ԭ�ϣ�Ϊ̽���������ȡ�Ͳ�������ʣ���������ʵ�顣
ʵ���ʵ������������������ˮ��Һ���Ʊ����ᣬװ����ͼ��ʾ��

��һ�����ĵ���ˮ��Һ����������ƿ��
�ڿ��Ʒ�Ӧ�¶�55��60�棬�߽�������μ�һ�����Ļ����(65%��H2SO4��98%��H2SO4��������2��1.25)
�۷�Ӧ3Сʱ����ȴ��Ȼ�����ؽᾧ�õ����ᾧ��
������������ˮ��Һ�ķ�ӦΪ��C6H12O6+12HNO3=3H2C2O4+9NO2��+3NO��+9H2O
��1��װ��B��������__��
��2����μ����װ�õ������ԣ�__��
��3��Ҫ���Ʒ�Ӧ�¶�55��60�棬Ӧѡ����ȵķ�ʽ��__��Cװ����Ӧ����__��Һ��
ʵ���̽�����������Ը�����صķ�Ӧ
��4���������Һ����μ������ữ�ĸ��������Һʱ���ɹ۲쵽��Һ���Ϻ�ɫ��Ϊ������ɫ��д��������Ӧ�����ӷ���ʽ��___��
��5��ѧϰС���ͬѧ���֣����������Һ����μ��������ữ�ĸ��������Һʱ����Һ��ɫ����������죬Ϊ̽����ԭ��ͬѧ���������¶Ա�ʵ�飺
ʵ����� | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) ����(g) | ��ɫʱ��(g) | ||
c(mol��L-1) | V(mL) | c(mol��L-1) | V(mL) | |||
ʵ��1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
ʵ��2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
�ɴ�����Ϊ��Һ��ɫ������������ԭ����__��
��6��Ϊ�ⶨ����ʵ���еõ�����Ĵ��ȣ�ȡ5.0g�ò�����Ʒ�����Ƴ�250mL��Һ��Ȼ��ȡ25.00mL����Һ������ƿ�У���0.10mol/L����KMnO4��Һװ��__(����������)�н��еζ����ﵽ�ζ��յ�ʱ��������__������������KMnO4��Һ���Ϊ20.00mL����ò�����Ʒ�Ĵ���Ϊ__��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com