
某校化学研究性学习小组学习了化学反应与能量的内容后,对
CaCO3与稀盐酸的反应进行了相关探究。他们在室温条件下,将CaCO3
块状固体放入1L、1mol•L-1稀盐酸中,记录下了随反应时间的变化生成
CO2气体的物质的量情况,绘制成如图曲线。假设溶液的体积变化忽略
不计,请分析以下问题:
(1)若想加快该反应的速率,可以采取的措施是 、
(答两种)。
(2)0~2min内,用HCl浓度变化表示的平均反应速率为 ,比较0~2min、2~4min、4~6min三个时间段,反应速率最大的是 。
(3)根据定量的数据,定性的描述0~6min内该反应的化学反应速率的变化情况
呈现这种变化的原因是 。
(4)根据图像中曲线的变化趋势,第8min时,该反应的反应速率为 。
【考点】本题考查反应速率大小的判断,反应速率的求算,根据图像分析问题、解决问题的能力。
【解析】(1)CaCO3与稀盐酸的反应中,想加快反应速率,可以采取的措施是:升高温度、将块状固体碾成粉末、适当增加盐酸浓度等。
(2)0~2min内,用HCl浓度变化表示的平均反应速率为0.2mol/L÷2min=0.1mol/(L·min)。
0~2min、2~4min、4~6min三个时间段,2~4min生成二氧化碳的物质的量最大,则反应速率最大。
(3)0~6min内该反应的化学反应速率的变化是反应在0~2 min内较慢,2~4 min内加快,4~6 min内又变慢,造成的原因为: 0~2 min内温度较低,反应慢,随着反应进行,放出的热量使反应体系温度升高,2~4 min内加快,之后,盐酸浓度下降,4~6 min内又变慢。
(4)根据图像,6min后反应停止,故8min时,该反应的反应速率为0。
【答案】(1)升高温度、将块状固体碾成粉末、适当增加盐酸浓度等(答对两种即得2分)
(2)0.1mol/(L·min)(2分) 2~4 min(1分)
反应在0~2 min内较慢,2~4 min内加快,4~6 min内又变慢(2分,合理答案均给分) 0~2 min内温度较低,反应慢,随着反应进行,放出的热量使反应体系温度升高,2~4 min内加快,之后,盐酸浓度下降,4~6 min内又变慢(2分,合理答案均给分)
(4)0 mol/(L·min) (2分)


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
25°C和 101 kPa时,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为( )
A.12.5% B.25%
C.50% D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s) 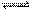 xC(g)+D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1 ,下列结论错误的是( )
xC(g)+D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1 ,下列结论错误的是( )
A.A的平均反应速率为0.15 mol•L-1•min-1 B.平衡时,C的浓度为0.25mol•L-1
C.B的平均反应速率为0.1 mol•L-1•min-1 D.平衡时,容器内压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:CO(g)+H2O(g)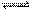 CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容 绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容 绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少
D.容器Ⅰ、Ⅲ中反应的平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO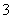
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如
图6所示。下列说法不正确的是
A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOx、CO和C等,请回答下列有关问题。
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为________________________________________________________________________,
汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由________能转化为________能,最终转化为机械能;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中________(填化学式)的排放;
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOx与CO反应的化学方程式__________________________________________________ ______________________
______________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为交警在对驾驶员是否饮酒进行检测。其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
如图所示为交警在对驾驶员是否饮酒进行检测。其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物 ⑤乙醇可与羧酸在浓硫酸的作用下发生取代反 应
应
A.②⑤ B.②③
C.①③ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com