
【题目】化学能是人类生产、生活所需的主要来源之一,根据化学能与热能的转化回答下列问题。
(1)下列变化过程需要吸收能量的是___________;
A.氢气球发生爆炸 B.向污染的河水中投放生石灰 C.![]() D.
D.![]()
(2)反应C(石墨)C(金刚石)正向反应是吸热反应,由此可知下列说法正确的是________;
①石墨比金刚石更稳定 ②金刚石比石墨稳定 ③金刚石和石墨可以相互转化 ④金刚石和石墨不能相互转化
(3)已知断开1 molH2中的化学键需要吸收436kJ的能量,断开1 molCl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为_______;
(4)下列过程能实现热能转化成化学能的是___________;
A.燃料电池 B.火力发电 C.铝热焊接 D.煅烧石灰石
(5)下列属于新能源的是___________;
A.氢气 B.煤炭 C.天然气 D.石油
(6)下列对化学反应的认识中错误的是___________;
A.会引起化学键的变化 B.会产生新物质 C.必然引起物质状态的变化 D.必然伴随着能量的变化
【答案】D ①③ 放出183kJ能量 D A C
【解析】
(1)A.氢气球发生爆炸,放出热量,故A不选;
B.向污染的河水中投放生石灰,氧化钙和水化合,放热反应,故B不选;
C.![]() 形成Cl-Cl键,放热,故C不选;
形成Cl-Cl键,放热,故C不选;
D.![]() ,拆开化学键,需要吸收能量,故D选;
,拆开化学键,需要吸收能量,故D选;
故答案为:D;
(2)反应C(石墨)C(金刚石)正向反应是吸热反应,①石墨能量低,石墨比金刚石更稳定,故正确;②金刚石能量高,金刚石比石墨稳定差,故错误;③金刚石和石墨在一定条件下,可以相互转化,故正确;④金刚石和石墨能相互转化,故错误;
故答案为:①③;
(3)H2(g)+Cl2(g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ·mol-1+243kJ·mol-1-2×431kJ·mol-1=-183kJ·mol-1,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=-183kJ·mol-1,故答案为:放出183kJ能量;
(4)A.燃料电池是化学能转化为电能,故不选;
B.火力发电化学能转化为机械能再转化为电能,故B不选;
C.铝热焊接化学能转化为热能,故C不选;
D.煅烧石灰石热能转化成化学能,故D选;
故答案为:D;
(5)A.氢气属于新能源,故A选; B.煤炭属于化石燃料,故不选; C.天然气属于化石燃料,故不选;D.石油属于化石燃料,故不选;
故答案为:A;
(6)A.化学反应是旧键断裂,新键生成,会引起化学键的变化,故A正确; B.化学反应会产生新物质,故B正确; C.化学反应不一定引起物质状态的变化,故C错误; D.化学反应必然伴随着能量的变化,故D正确;
故答案为:C。


科目:高中化学 来源: 题型:
【题目】2019年科学家们合成了具有半导体特性的环状C18分子,其合成方法的示意图如下:
C24O6![]() C22O4
C22O4![]() C20O2
C20O2![]() C18
C18
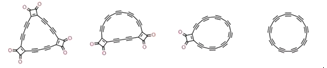
下列说法不正确的是
A.C与O同属第二周期元素,原子半径C>O
B.非金属性C<O,故C24O6中O显负价
C.C22O4分子中含有极性键和非极性键
D.C18与C60、金刚石互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
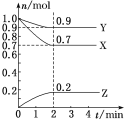
(1)由图中所给数据进行分析,该反应的化学方程式为____________________
(2)反应从开始至2min,用Z的浓度变化表示的平均反应速率为v(Z)=__________________。
(3)2min反应达平衡容器内混合气体的总压强比起始时________(填“增大”“减小”或“不变”);混合气体密度比起始时________(填“增大”“减小”或“不变”)。
(4)下列措施能加快反应速率的是________。
A.恒压时充入He B.恒容时充入He
C.恒容时充入X D.及时分离出Z
E.升高温度F.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应如下:
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g) ![]() H=-197 kJ/mol
H=-197 kJ/mol
下列说法正确的是
A. 因为反应放热,所以该反应不需要加热即能快速反应
B. 增大O2的浓度可以提高反应速率和SO2的转化率
C. 反应450℃时的平衡常数小于500℃时的平衡常数
D. 恒温下缩小容器容积,使Q > K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. HC1的电子式:![]() B. CO2的比例模型:
B. CO2的比例模型: ![]()
C. 乙酸的分子式:CH3COOH D. 甲烷的实验式为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 硫化氢溶液呈酸性:H2S ![]() 2H++S2–
2H++S2–
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) ![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是
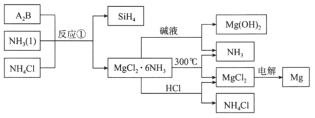
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季下雪后,城市道路常使用融雪剂,其主要成分的 化学式为 XY2,X、Y 均为周期表前 20 号元素,其阳离子和阴离子电子层结构相同,且 1 mol XY2 含有 54 mol 电子。
(1)Y在周期表中的位置为_________,该融雪剂的化学式是________,该物质中化学键类型是________。
(2)元素 D、E 原子的最外层电子数均是其电子层数的2倍,D与Y相邻,则D的原子结构示意图是_____;D 与 E 能形成一种结构类似于 CO2 的三原子分子,且每个原子均达到了 8e-稳定结构,该分子的电子式为_______。
(3)元素Z的M层电子比L层少5个,Z与NaOH溶液反应的现象是_______,反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。

(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com