
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
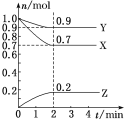
(1)由图中所给数据进行分析,该反应的化学方程式为____________________
(2)反应从开始至2min,用Z的浓度变化表示的平均反应速率为v(Z)=__________________。
(3)2min反应达平衡容器内混合气体的总压强比起始时________(填“增大”“减小”或“不变”);混合气体密度比起始时________(填“增大”“减小”或“不变”)。
(4)下列措施能加快反应速率的是________。
A.恒压时充入He B.恒容时充入He
C.恒容时充入X D.及时分离出Z
E.升高温度F.选择高效的催化剂
【答案】3X+Y2Z 0.05mol·L-1·min-1 减小 不变 CEF
【解析】
X、Y的物质的量随时间的变化在减小,Z的物质的量随时间的变化在增加,故X、Y是反应物,Z是生成物,根据变化的物质的量之比等于化学计量数之比可以得到反应的化学方程式。根据![]() 计算出Z的速率。根据化学方程式确定平衡容器内混合气体的压强变化,根据密度公式
计算出Z的速率。根据化学方程式确定平衡容器内混合气体的压强变化,根据密度公式![]() 计算。从影响化学反应的速率因素考虑,据此分析。
计算。从影响化学反应的速率因素考虑,据此分析。
(1)X、Y的起始物质的量均为1mol,随着时间的变化,物质的量在减小,为反应物,Z的起始物质的量为0,为生成物,2分钟后,X、Y、Z的物质的量不再发生变化,达到平衡状态,平衡时,X、Y、Z的物质的量分别为0.7mol、0.9mol、0.2mol, X、Y、Z的变化的物质的量分别为0.3mol、0.1mol、0.2mol,变化的物质的量之比等于化学计量数之比,可以得到化学反应方程式为:3X+Y2Z;
(2)反应从开始至2min,容器的体积为2L,用Z的浓度变化表示的平均反应速率为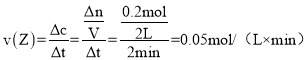 ;
;
(3)根据反应方程式:3X+Y2Z,X、Y、Z均为气体,X、Y的起始物质的量均为1mol,起始气体的总物质的量为2mol,由图中数据可知,平衡时气体的总物质的量为0.7mol+0.9mol+0.2mol=1.8mol,在相同情况下,气体的压强之比等于物质的量之比,故2min反应达平衡时,容器内混合气体的总压强比起始时减小;从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变;
(4) A.恒压时充入He,体系分压减小,反应速率减小,故A错误;
B.恒容时充入He,不影响体系压强和浓度,反应速率不变,故B错误;
C.恒容时充入X,X的浓度增大,反应速率加快,故C正确;
D.及时分离出Z,浓度不增加,压强减小,平衡右移,反应速率不加快,故D错误;
E.升高温度,任何化学反应速率加快,故E正确;
F.选择高效的催化剂,反应速率加快,故F正确;
故答案为:CEF;


科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式书写正确的是
A. 乙烯与溴的加成反应: H2C===CH2+Br2 → CH3CHBr2
B. 苯与硝酸的取代反应:![]() +HNO3
+HNO3 ![]() +H2O
+H2O
C. 乙醇与氧气的催化氧化:2CH3CH2OH+O2 ![]() 2CO2+3H2O
2CO2+3H2O
D. 乙醇与乙酸的酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是
A.化学反应除了生成新物质外,肯定也发生了能量变化
B.已知C(石墨,s)===C(金刚石,s)ΔH>0,则金刚石比石墨稳定
C.含20.0gNaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为NaOH(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() Na2SO4(aq)+H2O(l)ΔH=57.4kJ·mol-1
Na2SO4(aq)+H2O(l)ΔH=57.4kJ·mol-1
D.已知I2(g)+H2(g)=2HI(g)ΔH1,I2(s)+H2(g)=2HI(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用废铁渣(含Fe2O3、FeO、Al2O3、MnO2、CuO、SiO2等杂质)制备绿矾(FeSO4·7H2O)并回收Cu的流程如图:
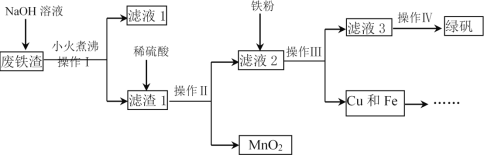
请回答下列问题:
(1)操作II所需的玻璃仪器有烧杯、玻璃棒和___。
(2)NaOH溶液的作用是溶解废铁渣中的___和___。
(3)写出向滤液2中加入铁粉的有关反应的离子方程式___(任写一个)。
(4)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。由此可知___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是( )
实验 | 实验现象 | 实验结论 | |
A | 用洁净的铂丝蘸取少量溶液在酒精灯外焰上灼烧 | 火焰呈黄色 | 该溶液中一定含有Na+,无K+ |
B | 向某溶液中加入BaCl2溶液 | 有白色沉淀 | 该溶液中一定有SO |
C | 将某气体通入品红溶液 | 红色褪去 | 该气体一定是SO2 |
D | 将一小块用砂纸打磨过的铝箔在酒精灯上加热 | 熔化的液态铝不会滴落 | 表面生成的Al2O3薄膜熔点较高 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能是人类生产、生活所需的主要来源之一,根据化学能与热能的转化回答下列问题。
(1)下列变化过程需要吸收能量的是___________;
A.氢气球发生爆炸 B.向污染的河水中投放生石灰 C.![]() D.
D.![]()
(2)反应C(石墨)C(金刚石)正向反应是吸热反应,由此可知下列说法正确的是________;
①石墨比金刚石更稳定 ②金刚石比石墨稳定 ③金刚石和石墨可以相互转化 ④金刚石和石墨不能相互转化
(3)已知断开1 molH2中的化学键需要吸收436kJ的能量,断开1 molCl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为_______;
(4)下列过程能实现热能转化成化学能的是___________;
A.燃料电池 B.火力发电 C.铝热焊接 D.煅烧石灰石
(5)下列属于新能源的是___________;
A.氢气 B.煤炭 C.天然气 D.石油
(6)下列对化学反应的认识中错误的是___________;
A.会引起化学键的变化 B.会产生新物质 C.必然引起物质状态的变化 D.必然伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
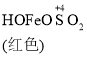
![]()
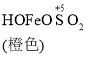
![]() Fe2++SO42-
Fe2++SO42-
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com