
【题目】冬季下雪后,城市道路常使用融雪剂,其主要成分的 化学式为 XY2,X、Y 均为周期表前 20 号元素,其阳离子和阴离子电子层结构相同,且 1 mol XY2 含有 54 mol 电子。
(1)Y在周期表中的位置为_________,该融雪剂的化学式是________,该物质中化学键类型是________。
(2)元素 D、E 原子的最外层电子数均是其电子层数的2倍,D与Y相邻,则D的原子结构示意图是_____;D 与 E 能形成一种结构类似于 CO2 的三原子分子,且每个原子均达到了 8e-稳定结构,该分子的电子式为_______。
(3)元素Z的M层电子比L层少5个,Z与NaOH溶液反应的现象是_______,反应的离子方程式为_______。
【答案】第三周期第VIIA 族 CaCl2 离子键 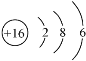
![]() 有气泡产生 2Al+2OH-+2H2O=2
有气泡产生 2Al+2OH-+2H2O=2![]() +3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
+3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
【解析】
(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为![]() =18,则为Ca2+、Cl-,XY2是CaCl2,X为Ca元素,Y为Cl元素。
=18,则为Ca2+、Cl-,XY2是CaCl2,X为Ca元素,Y为Cl元素。
(2)元素 D、E 原子的最外层电子数均是其电子层数的2倍,则分别为C和S,D与氯元素相邻,则D为硫元素,E为C元素。
(3)元素Z的M层电子比L层少5个,则其M层电子数为8-5=3,所以Z为Al元素。
(1)Y为Cl元素,位于元素周期表第三周期第VIIA 族;根据分析可知该融雪剂为CaCl2;氯化钙中只含钙离子和氯离子之间的离子键;
(2)D为S,S原子的结构示意图为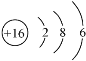 ;D 与 E 能形成一种结构类似于 CO2 的三原子分子,且每个原子均达到了 8e-稳定结构,该分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,电子式为
;D 与 E 能形成一种结构类似于 CO2 的三原子分子,且每个原子均达到了 8e-稳定结构,该分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,电子式为![]() ;
;
(3)Al可以与NaOH溶液反应生成氢气和偏铝酸钠(或四羟基合铝酸钠),所以可以看到有气泡生成,相应的离子方程式为2Al+2OHˉ+2H2O=2![]() +3H2↑或2Al+2OHˉ+6H2O=2[Al(OH)4]ˉ+3H2↑。
+3H2↑或2Al+2OHˉ+6H2O=2[Al(OH)4]ˉ+3H2↑。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是
A.化学反应除了生成新物质外,肯定也发生了能量变化
B.已知C(石墨,s)===C(金刚石,s)ΔH>0,则金刚石比石墨稳定
C.含20.0gNaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应的热化学方程式为NaOH(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() Na2SO4(aq)+H2O(l)ΔH=57.4kJ·mol-1
Na2SO4(aq)+H2O(l)ΔH=57.4kJ·mol-1
D.已知I2(g)+H2(g)=2HI(g)ΔH1,I2(s)+H2(g)=2HI(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能是人类生产、生活所需的主要来源之一,根据化学能与热能的转化回答下列问题。
(1)下列变化过程需要吸收能量的是___________;
A.氢气球发生爆炸 B.向污染的河水中投放生石灰 C.![]() D.
D.![]()
(2)反应C(石墨)C(金刚石)正向反应是吸热反应,由此可知下列说法正确的是________;
①石墨比金刚石更稳定 ②金刚石比石墨稳定 ③金刚石和石墨可以相互转化 ④金刚石和石墨不能相互转化
(3)已知断开1 molH2中的化学键需要吸收436kJ的能量,断开1 molCl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为_______;
(4)下列过程能实现热能转化成化学能的是___________;
A.燃料电池 B.火力发电 C.铝热焊接 D.煅烧石灰石
(5)下列属于新能源的是___________;
A.氢气 B.煤炭 C.天然气 D.石油
(6)下列对化学反应的认识中错误的是___________;
A.会引起化学键的变化 B.会产生新物质 C.必然引起物质状态的变化 D.必然伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将6 mol A和5 mol B混合,充入2 L密闭容器中,发生反应: 3A(g)+B(g)![]() xC(g)+2D(g),经5秒钟后生成1 mol D,并测得此时C的浓度为0.5molL-1。下列有关叙述正确的是( )
xC(g)+2D(g),经5秒钟后生成1 mol D,并测得此时C的浓度为0.5molL-1。下列有关叙述正确的是( )
A.此时A的浓度为2 mol·L-1B.x的值为1
C.B的转化率为20%D.反应速率v(D)=0.1molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
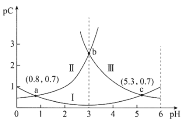
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 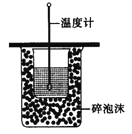
B. 比较Cu2+、Fe3+对反应速率的影响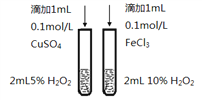
C. 比较醋酸和硼酸的酸性强弱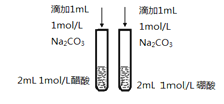
D. 比较温度对化学反应速率的影响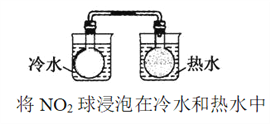
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
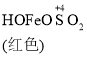
![]()
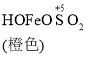
![]() Fe2++SO42-
Fe2++SO42-
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究MnO2与浓盐酸的反应,用如图所示的装置进行实验。
(1)B是用来收集气体的装置,但未将导管画全,请在装置图中将导管补画完整。_________
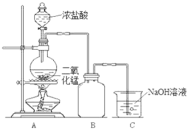
(2)制备实验开始时,先检查装置气密性,接下来的操作依次是_________(填字母)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中滴加浓盐酸
(3)实验中该同学取8.7g MnO2和50mL 12mol/L浓盐酸在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有固体剩余,该同学还检测到有一定量的盐酸剩余。
①MnO2与浓盐酸反应的化学方程式为_________。
②为什么有一定量的盐酸剩余但未能使MnO2完全溶解?_________。
③下列试剂中,能证明反应停止后烧瓶中有盐酸剩余的是_________(填字母)。
A.硝酸银溶液 B.碳酸钠溶液 C.氯化钠溶液
(4)为了测定反应残余液中盐酸的浓度,该同学设计了两个实验方案:
方案一:将A中产生的气体缓缓通过已称量的装有足量NaOH溶液的洗气瓶,反应停止后再次称量,两次质量差即是Cl2的质量,据此可求剩余盐酸的量。
方案二:当MnO2与浓盐酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生H2的体积为V L(已换算为标准状况下)。
①实际上方案一不合理,原因为_________。
②根据方案二,写出剩余盐酸的物质的量浓度的计算式(假设反应前后溶液的体积保持不变)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com