
 Ҫȷ���ջ�ѧ���P���ü�����������Ҫ��ش��������⣺
Ҫȷ���ջ�ѧ���P���ü�����������Ҫ��ش��������⣺| m |
| M |
| n |
| V |
| 28g |
| 14g/mol |
| 6 |
| x |
| 6 |
| x |
| 6 |
| x |
| 6 |
| x |
| 38.4g |
| 96g/mol |
| 0.4mol |
| 0.1L |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ȼ��һ����������ԭ��Ӧ |
| B��ȼ��һ����ų����� |
| C��ȼ��һ���������μ� |
| D��ȼ��һ�����з������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� |
| n(CH3OH) |
| n(CO2) |

| P2 |
| P1 |
| n(O2) |
| n(CH3OH) |
| n(O2) |
| n(CH3OH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
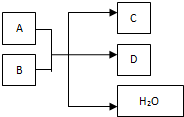 ��һ�������£�ijЩ��ѧ��Ӧ������ͼ��ʾ����ش���������
��һ�������£�ijЩ��ѧ��Ӧ������ͼ��ʾ����ش����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | �����Ϣ |
| X | Xһ�ֺ����ڿ���ʱ����������һЩ�������� |
| Y | Y��̬ԭ�ӵ�s���������P������������ |
| Z | Z���������ڵĵ��������а뾶��С |
| W | W�ĵ��ʱ���Ϊ����Ϣ�����Ĵ������������뵼����� |
| T | T�ж��ֻ�������ɫ���������ڿ����л�Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ﵽ��ѧƽ��ʱ���淴Ӧ��������Ҷ�Ϊ�� |
| B�������¶ȿ���߷�Ӧ���� |
| C��ʹ�ô�������������Ӧ���� |
| D������������Ũ�ȿ���߷�Ӧ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com